作者简介:吴逸飞(1975—),男,浙江东阳人,助理研究员,研究方向为饲料资源开发与利用。E-mail: 10400154@qq.com
采用酵母菌单菌和酵母菌、乳酸菌混菌对玉米、豆粕和麸皮组成的饲料进行好氧固态发酵,探索其对饲料营养成分和体外功能活性的影响。结果表明,发酵后,粗蛋白、总磷和低分子量肽含量显著( P<0.05)提高,而粗脂肪含量显著( P<0.05)降低。氨基酸方面,酵母单菌和混菌发酵后,天冬氨酸、丝氨酸、酪氨酸、苯丙氨酸和精氨酸的含量显著( P<0.05)提高。与发酵前相比,酵母单菌发酵还显著( P<0.05)提高了总氨基酸含量。饲料经过单菌和混菌发酵后,总酚含量、维生素B2、B6以及咖啡酸、没食子酸的含量亦显著( P<0.05)提高。体外功能评价试验表明,发酵饲料提取液对大肠埃希菌、金黄色葡萄球菌、藤黄微球菌和沙门氏菌等4种指示菌均有抑制效果,并对酵母菌和乳酸菌有促生长作用。由此可知,在本试验条件下,酵母单菌发酵和酵母、乳酸菌混菌发酵处理可有效提高饲料的营养品质。
To determine the effects of microbial solid-state fermentation on nutritional compositions and in vitro functional activity, the formula feed consisted of corn, soybean meal and wheat bran was fermented with single Saccharomyces cerevisiae strain or mixed stain of S. cerevisiae and Lactobacillus casei. It was shown that contents of crude protein, total phosphorus and low-molecular weight peptide were increased ( P<0.05), whereas the crude fat content was decreased ( P<0.05). Amino acid determination depicted an increase ( P<0.05) in concentrations of aspartate, serine, tyramine, phenylalanine and arginine after the single or mixed fermentation. Moreover, the total amino acid concentration was higher ( P<0.05) in S. cerevisiae-fermented feeds, compared with un-fermented feed. The contents of total phenol, VB2, VB6, caffeic acid and pyrogallic acid were also increased ( P<0.05). Functional assessment in vitro showed that the water extracts of fermented feed had anti-microbial effect ( P<0.05) on the growth of intestinal pathogens, including Escherichia coli, Staphylococcus aureus, Micrococcus luteus and Salmonella enterica. The extracts also had promoting effect ( P<0.05) on the growth of S. cerevisiae and L. casei. In conclusion, the fermentation with S. cerevisiae alone or mixed with L. casei could improve the nutritional quality of feeds.
微生物发酵饲料是利用有益微生物发酵单一或混合饲料原料, 提高饲料利用率, 同时包含多种微生物代谢功能活性物质的新型生物饲料[1]。国外较先采用液态发酵技术制备发酵饲料, 并在生猪养殖中取得了许多有益效果, 如降低动物肠道中病原菌数量, 减少肠道疾病的发生等[2]。但液态发酵饲料的应用也存在诸多问题, 如部分游离氨基酸的发酵损耗以及液态饲料的单位营养成分浓度较固态饲料低等[3, 4]。
固态发酵是改善饲料原料品质的有效手段。目前, 国内外研究团队在采用好氧固态发酵手段处理豆粕[5]、棉籽粕[6]、菜籽粕[7]等植物蛋白原料方面取得了良好效果。研究表明, 饲料原料中大分子物质(淀粉、蛋白质和纤维素等)可在发酵过程中转化为利于动物肠道吸收的小分子物质, 并可有效减少或去除发酵物料中的抗营养因子, 同时产生多种生物活性物质, 如活性肽、寡糖、醇类等, 有助于改善动物肠道微生态平衡, 与常规饲料相比, 优势明显[5, 6, 7, 8]。
但目前有关采用固态发酵工艺处理混合饲料原料的报道还较少, 多局限于固态发酵饲料菌种选育[9]和对养殖动物的饲养效果评价等方面[10]。关于固态发酵饲料的营养品质, 特别是代谢物质及其活性分析等尚缺乏报道。本研究采用酵母菌单菌发酵和酵母菌、乳酸菌混合发酵2种模式对豆粕、玉米和麸皮组成的混合饲料原料进行好氧固态发酵, 研究发酵前后物料营养成分变化, 以期为固态发酵饲料的推广应用提供理论依据。
1.1.1 试验菌种
大肠埃希菌O157:H7(Escherichia coli NCTC12900)、金黄色葡萄球菌(Staphylococcus aureus CMCC26003)、藤黄微球菌(Micrococcus luteus CMCC28001)和沙门氏菌(Salmonella enterica CMCC50071)均购自广东环凯微生物科技有限公司。枯草芽孢杆菌(Bacillus subtilis)BS3、酿酒酵母(Saccharomyces cerevisiae)Yn和干酪乳杆菌(Lactobacillus casei)EM均为课题组实验室培养选育和保藏菌株。
1.1.2 主要原料
玉米、豆粕和麸皮均购自绍兴科盛饲料有限公司。玉米含水率12.6%, 粗蛋白含量8.9%; 豆粕含水率10.4%, 粗蛋白含量46.1%; 麸皮含水率9.5%, 粗蛋白含量18.9%。原料粉碎过40目筛备用。
1.1.3 培养基
大肠埃希菌、金黄色葡萄球菌、藤黄微球菌、沙门氏菌和枯草芽孢杆菌的培养基为LB培养基, 酿酒酵母Yn和干酪乳杆菌EM的培养基分别为YPD培养基和MRS培养基[7]。
TG16-WS台式高速离心机, MTX-250智能恒温培养箱, Waters e2695高效液相色谱仪, FOSS 8400全自动凯氏定氮仪, SpectraMax M5多功能酶标仪等。
1.3.1 好氧固态发酵饲料的制备
发酵底物为玉米70%、豆粕25%、麸皮5%的混合原料100 g, 将上述原料混匀后, 装入500 mL广口瓶中[1], 其中:单菌发酵仅接种酵母菌Yn, 接种量1.5%(V/m), 料水比1:0.8, 自然pH, 物料混合均匀后, 于30 ℃培养36 h; 混合发酵接种1.5%(V/m)酵母菌Yn与乳酸菌EM的混合菌液(比例为1:1, V/V; 酵母菌Yn与乳酸菌EM的菌落数分别为3.8× 108和1.2× 109 cfu· mL-1), 料水比1:0.8, 自然pH, 30 ℃培养 48 h。发酵完毕后在50 ℃条件下烘干, 粉碎过60目筛用于营养成分测定。
1.3.2 饲料常规营养成分分析及微量元素测定
水分的测定参照GB/T 5009.3— 2003, 采用105 ℃恒重法; 粗蛋白的测定参照GB/T 5009.5— 2003, 采用凯氏定氮法; 灰分的测定参照GB 5009.4— 2010食品中灰分的测定方法; 粗脂肪的测定参照GB/T 14772— 2008, 采用索氏提取法; 低分子肽含量测定参照Folin-酚法[11]; 氨基酸含量由农业部农产品及转基因产品质量安全监督检验测试中心(杭州)检测。
1.3.3 发酵产物中多酚和维生素含量的分析
总酚测定参照GB/T 8313— 2008茶叶中茶多酚和儿茶素类含量的检测方法进行; 维生素B1的检测参照GB/T 14700— 2002饲料中维生素B1的测定方法; 维生素B2检测参照GB/T 14701— 2002饲料中维生素B2的测定方法; 维生素B6检测参照GB/T 14702— 2002饲料中维生素B6的测定方法进行。水杨酸、咖啡酸和没食子酸等酚酸含量的测定参照文献[12]的方法进行。
1.3.4 发酵饲料提取液对4种常见致病指示菌的抑制效果
分别取单菌和混菌发酵样品烘干样各10 g, 加去离子水90 mL, 超声提取20 min后, 4 000 r· min-1离心5 min, 取全部离心上清液冷冻干燥备用。测定时取0.5 g冷冻干燥物加入10 mL去离子水溶解, 0.22 μ m滤膜过滤后用于检测抑菌效果和对益生菌生长的影响。
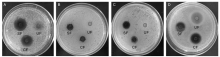
抑菌活性的测定参照牛津杯法[9]。分别取0.1 mL适当稀释的金黄色葡萄球菌、大肠埃希菌、沙门氏菌和藤黄微球菌等4种指示菌的培养液均匀涂布于LB平板上, 待培养基表面干燥后, 将灭菌的不锈钢牛津杯放置在培养基表面, 分别加入上述制备提取液200 μ L, 于37 ℃恒温培养24 h后, 观察对指示菌的抑菌效果, 拍照并测量抑菌圈直径。
1.3.5 发酵饲料提取液对3种有益菌生长的影响
参照刘丽莎等[13]方法略有修改。指示菌选取酵母菌Yn、芽孢杆菌BS3和乳酸菌EM。分别在这3株菌各自培养基中(见1.1.3节)额外加入1%(V/V)提取液(制备方法同1.3.4节), 随后接种1%的酵母菌和芽孢杆菌培养液, 于30 ℃、160 r· min-1摇瓶培养24 h后, 通过涂布平板计数; 接种1%的乳酸菌EM, 于37 ℃静置培养48 h后, 通过混平板法计数, 以加入发酵前原料提取浓缩液的培养基为对照, 测定发酵提取液对指示菌生长的影响。
数据处理与分析采用SPSS 13.0统计软件进行单因子方差分析, 对有显著差异组间采用Duncan氏分析进行多重比较, 结果以平均值± 标准差表示。
饲料经过酵母菌单菌发酵和酵母菌、乳酸菌混合发酵后, 发酵物中粗灰分、粗蛋白、粗脂肪、总磷和低分子肽含量的变化见表1。粗蛋白、总磷和低分子量肽含量在发酵后显著(P< 0.05)提高, 而粗脂肪含量显著(P< 0.05)降低。其中, 酵母单独发酵饲料中低分子量肽含量显著(P< 0.05)高于混菌发酵饲料。粗灰分含量在发酵前后无显著变化。
| 表1 发酵前后饲料中营养成分的组成 Table 1 Effects of solid-state fermentation on components of feed % |
饲料发酵前后氨基酸含量变化见表2。酵母单菌和混菌发酵后, 天冬氨酸、丝氨酸、酪氨酸、苯丙氨酸和精氨酸的含量显著(P< 0.05)提高。与发酵前相比, 酵母单菌发酵还显著(P< 0.05)提高了总氨基酸含量。
| 表2 微生物发酵饲料中氨基酸含量的变化 Table 2 Effects of solid-state fermentation on amino acid content of feed % |
由表3可知, 饲料经过单菌和混菌发酵后, 总酚含量、维生素B2和B6以及酚类化合物咖啡酸、没食子酸的含量显著(P< 0.05)提高。与发酵前相比, 酵母单独发酵还显著(P< 0.05)提高了维生素B1和水杨酸的含量。
| 表3 发酵前后物料中多酚和维生素含量的测定 Table 3 Effects of solid-state fermentation on the contents of phenolic acids and vitamins of feed |
试验测定了发酵饲料提取液对大肠埃希菌、金黄色葡萄球菌、藤黄微球菌和沙门氏菌等4种指示菌的抑制作用, 结果见表4和图1。两种发酵饲料提取液对4种指示菌均有抑制效果, 而发酵前饲料提取液对指示菌无明显抑制作用。由表4可知, 提取液对大肠埃希菌的抑制效果最强。
| 表4 单菌和混菌发酵饲料提取液对4种指示菌的抑菌效果 Table 4 Effects of water extracts of fermented feed with single or combined strains on the growth of indicator strains mm |
试验选取酵母菌(酿酒酵母Yn)、芽孢杆菌(枯草芽孢杆菌BS3)和乳酸菌(干酪乳杆菌EM)作为指示菌株, 通过测定活菌数来反映发酵饲料提取液对这3种有益菌生长的影响, 结果见表5。两种提取液对Yn和EM的生长均具有显著(P< 0.05)促进作用, 但发酵饲料提取物对BS3的生长无明显作用。
| 表5 提取液对3种指示菌的促生长作用 Table 5 Effects of water extracts of fermented feed with single or combined strains on the growth of indicator strains 108 cfu· mL-1 |
本研究发现, 单菌和混菌发酵饲料中粗蛋白、总磷和低分子量肽的含量较发酵前显著提高。这与前人在发酵菜籽粕[14]和发酵豆粕[5]等固态发酵物料上的研究结果一致。Canibe等[15]的研究表明, 在发酵过程中, 微生物优先利用物料中的糖类等能量物质用于自身生长, 从而间接导致发酵后物料中粗蛋白和总磷等其他营养元素含量提高。发酵后饲料中低分子量肽的含量增加则与微生物所产的蛋白酶分解高分子蛋白有关[8, 14]。低分子量肽与常规蛋白相比, 具有更易被动物肠道吸收的特点, 因而提高了蛋白的利用率。同时, 本研究还发现, 发酵后饲料中粗脂肪含量显著降低, 表明粗脂肪在发酵过程中被降解, 这与Sun等[6]在固态发酵棉籽粕中的结果一致。粗脂肪含量下降的原因可能与微生物利用脂肪来支持菌体的生长有关, 并进一步促进了发酵后饲料中总磷含量和粗蛋白含量的提高。
氨基酸方面, 微生物发酵后显著提高了天冬氨酸、丝氨酸、酪氨酸、苯丙氨酸和精氨酸的含量。此外, 酵母菌单菌发酵饲料中总氨基酸含量显著提高。本研究中总氨基酸和特定氨基酸含量的提高与发酵后物料中粗蛋白含量的提高有关, 而氨基酸含量在发酵后的变化直接反映了发酵微生物的氨基酸利用偏好。目前, 有关发酵对混合饲料原料中氨基酸含量变化的报道较少。Shi等[14]在固态发酵菜籽粕的研究中发现, 发酵后可显著提高天冬氨酸、甘氨酸、丝氨酸、酪氨酸、苯丙氨酸、精氨酸、苏氨酸和缬氨酸的含量, 这与本试验结果相类似。
酵母发酵产物中含有大量的氨基酸、核酸等生物活性物质。研究表明, 固态发酵显著提高了饲料中维生素B1、B2、B6的含量[15]。林标声等[16]在固态发酵以豆粕、玉米蛋白粉、麸皮、花生粕等原料组成的饲料后发现, 饲料中的主要维生素为B族维生素, 且其含量随发酵时间延长而逐渐提高。同样, 吴妍妍等[17]采用嗜酸乳杆菌发酵棉籽粕混合饲料后表明, 发酵饲料中维生素B1、B2和B5的含量均较发酵前显著提高。上述结果均与本研究结果一致。
多酚类物质(包括酚酸)是一类在饲用原料中广泛存在的植物次生代谢产物, 具有抑菌、抗氧化等多种生物学功能[12, 18]。本研究结果显示, 饲料中总酚及咖啡酸和没食子酸等酚酸的含量在发酵后显著提高, 该结果与Dey等[19]在小麦固态发酵中的结果类似。国外研究表明, 酿酒酵母、曲霉和芽孢杆菌等益生菌可在固态发酵和半固态发酵植物副产物中产生包括酚酸、单宁酸在内的多种多酚化合物, 从而显著提高发酵物料的功能价值[18]。此外, 本研究还发现, 酵母菌单菌发酵饲料中水杨酸和没食子酸的含量显著高于混合发酵饲料, 说明酵母单独发酵饲料的功能活性可能优于混菌发酵物。这与乳酸菌在发酵中产酸导致物料pH下降, 抑制酵母菌生长有关。
近年来, 研究发酵饲料对动物肠道菌群影响的研究较多, 但较少有发酵饲料提取物体外抑菌和促生长作用的报道[20]。舒刚等[10]研究表明, 肉鸡饲喂发酵饲料可显著降低肠道内容物pH值, 减少肉鸡回肠中大肠埃希菌、金黄色葡萄球菌的数量, 提高肠道乳酸杆菌数量。本试验结果显示, 酵母发酵饲料和混菌发酵饲料提取物在体外也具有明显的抑菌作用, 表明发酵饲料除了通过益生菌在动物体内发挥功效外, 本身可能亦含有抑菌活性物质。预实验发现, 提取液的pH值均在5~6之间, 因而发酵饲料提取液的抑菌效果也可能与提取液pH值有关。上述结果与Canibe等[15]在液态发酵饲料上的研究结果一致。同时, 本研究还发现, 发酵饲料提取物可在体外显著促进干酪乳杆菌和酿酒酵母的生长, 可能与酵母发酵过程中所产生的多糖类物质有关[21, 22], 具体机制还需进一步研究, 但该结果为动物饲喂发酵饲料改善肠道内乳酸菌含量提供了数据支持。
综上, 本研究发现, 酵母单菌发酵或酵母、乳酸菌混菌发酵处理可明显提高饲料的一些常规营养成分和氨基酸含量及其酚类、B族维生素水平, 增强饲料提取液对指示菌的体外抑菌和促生长效果, 从而有效改善饲料的营养品质。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|