作者简介:宋晓隽(1990—),女,四川成都人,硕士,研究方向为生物技术在果树上的应用。E-mail: xiaosone27@foxmail.com
采用不同浓度的ABA合成抑制剂NDGA处理红颜草莓果实,通过测定草莓果实不同时期脱落酸及成熟着色相关生理指标以及ABA代谢相关基因的变化,以了解NDGA对脱落酸及其关键调控基因表达的影响。结果表明,NDGA能有效抑制可溶性糖和天竺葵素葡萄糖苷的合成,且在一定范围内浓度越高,抑制作用越明显。一定浓度的NDGA处理可以抑制 FaNCED的表达,并促进 FaCYP707 A、 FaBG1和 FaCHLH在草莓果实褪绿期的表达。该结果为进一步揭示NDGA抑制脱落酸代谢的机制提供了研究基础。
The Benihoppe strawberry was treated with different concentrations of nordihydroguaiaretic acid (NDGA), which can depress the synthesis of abscisic acid (ABA) to investigate its influence on physiological indexes and related gene expression. The results showed that NDGA could significantly inhibit biosynthesis of soluble sugar and pelargonidin 3-O-glucoside chloride, and the inhibition became more obvious with the increasing concentration. In addition, FaNCED was inhibited and FaCYP707 A, FaBG1 and FaCHLH were accelerated with a certain concentration of NDGA. Our study may provide helpful information for further study on molecular mechanism of NDGA on inhibiting the biosynthesis of ABA.
红颜草莓(Fragaria× ananassa Duch cv. Benihoppe)又名红脸颊、日本99号, 是日本农林省久枥木草莓繁育场以幸香为父本, 章姬为母本杂交选育而成的新品种, 具有果实大、长势强、香味浓、糖度高、耐贮运等特点[1]。近年来, 红颜草莓在全国各地广泛栽培, 并深受人们的喜爱。果实着色是草莓外观品质的重要指标, 决定了草莓的价格和市场竞争力。而脱落酸(abscisic acid, ABA)是果实成熟着色的关键激素, 能够有效调控非呼吸跃变型果实的成熟着色[2, 3]。 草莓果实中的ABA合成受一些关键酶的影响, 其中9-顺式-环氧类胡萝卜素双氧合酶(9-cis-epoxycarotenoid dioxygenase, NCED)是ABA合成的限速酶[4]; β -葡萄糖苷酶(β -D-glucosidase, BG)作为ABA代谢途径中的酶可以释放共价失活ABA-GEs中的ABA[5]; ABA 8’ -羟化酶(ABA 8’ -hydroxylases, CYP707A)可使ABA氧化失活从而负调控ABA含量[6]。此外, ABAR/CHLH是定位于叶绿体内参与了叶绿素合成的镁离子螯合酶H亚基的ABA受体[7]。近年来, 植物自身ABA的合成代谢及其调控基因的克隆与表达也受到广泛关注[8, 9], 去甲二氢愈创木酸(nordihydroguaiaretic acid, NDGA)作为ABA合成关键酶NCED的特异性抑制剂, 不仅能抑制果实中ABA的合成, 还能调控相关基因的表达[10, 11], 并最终影响果实的成熟[12, 13, 14], 但具体调控机制还鲜见报道。本试验以红颜草莓为材料, 通过不同浓度NDGA外源处理, 测定了草莓果实不同时期与成熟着色相关的生理指标(可溶性糖、有机酸、花色苷)以及ABA合成代谢关键酶基因FaNCED、FaCYP707A1、FaBG1、FaCHLH的表达情况, 为揭示草莓果实ABA积累及合成代谢机制奠定理论基础, 从而在生产实践中为草莓果实成熟、果实色泽的调控机制提供理论依据。
试材红颜草莓取自四川省双流县黄龙溪镇百安农业草莓种植基地。试验于2014年1月14日开始进行, 将花后7 d的草莓果实分别用30、50、70 μ mol· L-1的NDGA(DMSO溶解)以及100 μ mol· L-1ABA(正对照)、清水(CK)进行喷洒, 每隔5~7 d喷洒一次, 每次每果喷至处理液完全覆盖于果实表面, 以表面有第一滴水滴为限。花后7和14 d每次采果20个, 花后21、28、32 d每次采果10个, 草莓果实发育时期依次为小绿、大绿、纯白、片红、全红。同一处理, 取生长健壮, 整齐一致的一级果实, 液氮速冻后存储于-80 ℃超低温冰箱备用。
用美国R& D Systems 公司的植物激素脱落酸(ABA) ELISA KIT试剂盒测定草莓果实ABA含量, 将ABA标准品梯度稀释成300、150、75、37.5、18.75 μ L· L-1, 以标准品的浓度为横坐标, 波长为450 nm处的吸光度值为纵坐标, 绘制标准曲线。取1 g果实样品, 用液氮研磨, 加9 mL 0.01 mol· L-1磷酸缓冲液, pH控制在7.2~7.4, 按试剂盒的方法测定吸光度值, 并计算出相应的浓度。
可溶性糖含量采用蒽酮比色法[15]测定, 有机酸含量参照于鲁浩[16]的酸碱滴定法进行测定。花色苷含量测定参照张娟娟[17]、王博[18]的实验方法, 略有改动, 具体如下:称取0.5 g草莓果实, 加入液氮研磨, 加5 mL提取液(丙酮:水:甲酸=80:20:0.2), 在室温避光条件下振荡20 min, 于4 ℃, 8 000 r· min-1下离心20 min, 重复提取直至样品变为无色。合并上清液, 20 mL容量瓶定容, 用0.45 μ m水相滤膜过滤, 滤液即为可用于HPLC测定的待测液。采用Agilent 1260 LC高效液相色谱仪, G1214 VWD检测器, 检测波长525 nm, 柱温:25 ℃。色谱柱:Symmetry C18(4.6 mm× 150 mm, 5 μ m)。流动相A:1.6%甲酸水溶液, B:1.6%甲酸乙腈溶液; 洗脱条件:梯度洗脱, 0~4 min, 5% B; 4~12 min, 10% B; 12~20 min, 25% B; 20~25 min, 40% B, 流速1 mL· min-1, 以10 μ L滤液为进样体积。标准物质天竺葵素葡萄糖苷(3-O-β -glucopyranosides of pelargonidi, Pg3G)购于Sigma-Aldrich公司, 绘制标准曲线根据峰面积计算样品含量。
参照Chen等[19]改良CTAB法对各组处理的样品分别提取总RNA, 并检测RNA的完整性及纯度。以1 μ g检测合格的总RNA为模板, 根据宝生物工程(大连)有限公司, RT-PCR试剂盒(RR047A)使用手册进行cDNA第一链合成。
采用CFX 96(Bio-Rad, USA)进行qRT-PCR检测, 利用Beacon Designer 7.9软件进行特异引物设计, 引物序列如下表1所示。反应体系为SYBR Premix EX TaqTM(宝生物工程有限公司, 大连)5 μ L, 浓度为10 μ mol· L-1的上下游引物各0.4 μ L, cDNA 1 μ L及ddH2O 3.2 μ L。反应程序为:95 ℃预变性3 min, 95 ℃变性10 s, 55.7 ℃(或59 ℃) 退火30 s, 40个循环。每个样品重复3次, 并以Actin 作为内参。采用2-Δ Δ Ct的方法处理定量数据[20]。
| 表1 用于本实验的引物序列 Table 1 Primers used for gene expression in this study |
数据使用SPSS13.0及DPS 7.05数据包进行方差分析及相关性分析。
在果实的整个发育周期中, ABA含量随时间逐渐上升, 并伴有两个明显的峰值(图1), 第一个峰值在花后21 d(始红期), 第二个峰值在花后32 d(全红期)。经NDGA处理后, 草莓果实中ABA含量整体变化趋势不变, 但都低于对照, 各时期NDGA处理浓度越高, ABA含量越低。ABA处理(正对照)的草莓果实中ABA含量相对较高, 且随果实发育差异逐渐变大, 在花后28和32 d与对照组相比差异显著(P< 0.05)。
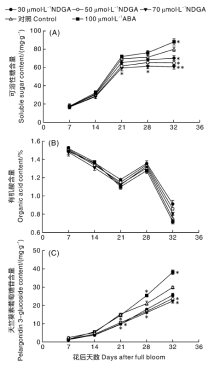
草莓果实中可溶性糖含量随着果实成熟逐步升高(图2)。在果实发育前期, 果实中糖含量的差距不大, 但从着色期(花后21 d)开始有明显差异。全红期时, 各处理与对照差异显著(P< 0.05), ABA处理的果实可溶性糖含量高于CK, 而NDGA处理的果实可溶性糖含量均低于CK, 且浓度越大, 含量越低。草莓果实整个成熟着色过程中, 有机酸含量整体呈现下降的趋势, 但在28 d有一个高峰, 各处理变化趋势一致, 且差异不显著。天竺葵素葡萄糖苷是草莓中最主要的花色苷, 在果实发育前期, 对照与不同处理之间天竺葵素葡萄糖苷含量差异不大, 随着果实逐渐成熟, 差异变大, NDGA处理浓度越高, 天竺葵素葡萄糖苷含量越低。70 μ mol· L-1 NDGA处理后的草莓果实各时期天竺葵素葡萄糖苷含量最低, 全红期时, 比正对照处理低15.5 mg· g-1, 与CK相比差异显著(P< 0.05)。
根据试验数据对果实中的可溶性糖、有机酸、天竺葵素葡萄糖苷与ABA进行相关性分析, 其与ABA的相关系数分别为r2=0.873, P=0.011 2; r2=-0.275, P=0.013 1; r2=0.932, P=0.0143, 表明果实中可溶性糖和天竺葵素葡萄糖苷与ABA呈显著性正相关关系, 有机酸与ABA关系不密切。
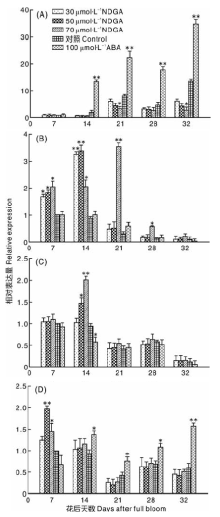
通过荧光定量PCR测定FaNCED、FaBG1、FaCYP707A1、FaCHLH的相对表达量, 以第一次采样时对照的表达量为参照(图3), 可以看出各处理FaNCED表达量整体呈上升趋势, 在花后21与32 d有峰值, 经ABA处理后FaNCED表达量与CK相比显著上升(P< 0.01), 而经NDGA处理后的表达量均低于CK组, 且各时期浓度越高, 表达量越低。随着果实的成熟, FaBG1呈逐渐下降趋势, 果实着色前期基因表达量呈现较高的水平, 果实着色开始后表达量处于较低水平, NDGA溶液处理后FaBG1基因相对于对照组在果实褪绿期表达量有所升高, 花后14 d与对照之间差异最大。各时期正对照(ABA处理)与CK之间差异不大。FaCYP707A1的表达整体呈下降趋势, 且在21 d时出现第一个谷值。经NDGA处理后, 在花后14 d 50 μ mol· L-1 NDGA, 70 μ mol· L-1 NDGA和ABA处理与对照相比差异显著(P< 0.05), 其他时期差异不显著。在果实发育前期和后期, FaCHLH的表达量相对较高, 着色开始(花后21 d)表达量为整个阶段的最低值, 经NDGA处理后在褪绿期(7~14 d), 其表达量高于CK, 其他时间低于CK组。正对照(ABA)处理后果实中的FaCHLH表达量从花后14 d开始高于CK。
果实品质包括外在品质和内在品质, 可溶性糖和有机酸是果实内在品质的重要指标[21]。果实色泽是影响草莓外在品质的重要指标, 草莓果实的颜色由花色苷决定, 已有研究表明天竺葵素葡萄糖苷是草莓中主要的花色苷[22]。草莓中可溶性糖和天竺葵素葡萄糖苷与ABA含量密切相关, NDGA可以抑制可溶性糖和天竺葵素葡萄糖苷的形成, 且浓度越高其抑制作用越明显, 说明NDGA可以通过抑制ABA的合成从而降低可溶性糖和天竺葵素葡萄糖苷的含量。另外, 有机酸含量总体呈下降趋势, 而刘士华等[21]和李春丽等[23]的研究发现草莓中有机酸含量呈先上升后下降的趋势, 这可能与草莓品种差异有关。
高等植物ABA合成主要途径为C40 间接途径[24], 参与该途径的酶主要包括玉米黄质环氧化酶(ZEP)、9-顺式-环氧类胡萝卜素双氧合酶(NCED)、短链脱氢/还原酶(SDR)和ABA醛氧化酶(AAO)[24, 25]。朱海生等[2]发现, FaNCED 基因在草莓根、茎、叶、花萼和果实中都有表达, 且其表达量与ABA积累量相吻合, 这与本试验结果一致, 说明FaNCED通过调控ABA的含量调控草莓成熟。任杰等[11]发现NDGA对PacNCED1在樱桃果实中的表达没有影响, 而本试验发现NDGA可以明显抑制FaNCED的表达。ABA可以通过两条不同的途径在植物体内分解代谢, 一条途径是通过CYP707A氧化使其失活[26], 另一条则是 ABA 或其分解代谢产物在糖基转移酶作用下形成共价失活的ABA-GEs[27]。草莓发育前期FaBG1表达较高, 而在后期FaNCED表达相对较高, 推测果实发育前期草莓中的ABA主要通过分解途径产生。FaBG1在草莓成熟过程中呈逐渐下降趋势, 表明其与草莓成熟关系不大[28], 但FaBG3被证明可以促进草莓成熟[29]。FaCYP707A1从白果期到全红期(21~32 d)其表达量与ABA含量变化趋势相反, 在结缕草种子的萌发中也有类似的情况[9], 说明CYP707A对ABA含量的影响占主导作用。目前已经鉴定的ABA受体有3类, 包括质膜上的G蛋白偶联受体, 胞质内含有START特征区受体 PYR/PYL/RCAR, 以及参与叶绿体合成的镁螯合酶H亚基ABAR/CHLH[30], 草莓果实中FaPYR1和 FaCHLH/ABAR作为正调控因子参与了草莓的成熟[31, 32]。本试验中, FaCHLH 的动态变化说明其与草莓的褪绿与着色密切相关。NDGA在草莓果实褪绿期一定程度上调了 FaCYP707A, FaBG1和FaCHLH的表达量, 可能是由于NCED-CYP707A和 GT-BG 分别以合成— 分解和结合— 解离途径调控植物细胞内的 ABA水平[30], 所以NCED、CYP707A和BG三者间存在动态平衡关系, FaNCED褪绿期表达量少, 所以经NDGA处理后FaCYP707A和FaBG1表达增多, 受体基因FaCHLH表达也随之增多。
综上所述, NDGA可以抑制草莓果实成熟过程中可溶性糖和天竺葵素葡萄糖苷的合成, 且在一定范围内浓度越高, 抑制作用越明显。在分子机制上, 一定浓度的NDGA可以抑制FaNCED的表达, 促进 FaCYP707A、FaBG1和FaCHLH在草莓果实褪绿期的表达。该结果初步揭示了NDGA对果实成熟过程中生理水平的影响以及NDGA调控ABA合成的分子机制, 为进一步研究ABA对草莓成熟着色的作用机制奠定理论基础。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|