作者简介:黄华毅(1989—),男,江西九江人,博士研究生,主要从事微生物与植物病害生物防治方面的研究。E-mail:hhy19890408@163.com
枯草芽孢杆菌( Bacillus subtilis)STO-12是从枣树根际土壤中分离获得的一株拮抗细菌。通过平板对峙法和菌丝生长速率法分别探究了STO-12及其无菌培养滤液的抑菌活性,并分别采用滤纸片法和二分皿法初步分析了其抑菌活性物质,为STO-12的开发利用提供技术指导。结果表明:STO-12及其无菌培养滤液均能有效抑制枣缩果病菌( Alternaria tenuissima)、杨树炭疽病菌( Colletotrichum gloeosporioides)和杨树腐烂病菌( Cytospora chrysosperma)的菌丝生长,其中,无菌培养滤液对这3种病原真菌的抑制率分别达到84.87%(7 d)、38.19%(7 d)和100%(3 d);STO-12分泌的蛋白类和脂肽类物质均表现出了较好的抑菌活性,且都能使生长的菌丝产生膨大畸形,其中,蛋白类物质对枣缩果病菌、杨树炭疽病菌和杨树腐烂病菌的抑菌圈直径分别为12.33、9.50和16.50 mm,脂肽类物质抑制作用形成的抑菌圈直径分别为17.50、17.06和21.50 mm;细胞壁裂解酶特性检测发现,STO-12能产生纤维素酶和蛋白酶;此外,STO-12的挥发性气体也具有一定的抑菌作用,对这3种病原菌的抑制率分别达到38.96%(3 d)、9.35%(3 d)和82.14%(2 d)。以上结果表明,枯草芽孢杆菌STO-12是一株能拮抗多种病原真菌且分泌多种抑菌物质的高效拮抗菌,具有进一步开发应用的前景。
Bacillus subtilis STO-12 was isolated from the rhizosphere soil of jujube plants as a biocontrol agent. In order to provide technical guidance for further exploitation and utilization of STO-12, the antifungal activities of STO-12 and its sterile culture filtrates were investigated by dual culture assay and colony diameter assay, respectively; and the antifungal substances of STO-12 were analyzed by paper disc method and two-compartment plate method, respectively. The results revealed that STO-12 and its sterile culture filtrates had strong antifungal activities, and the rates of sterile culture filtrates inhibited Alternaria tenuissima, Colletotrichum gloeosporioides and Cytospora chrysosperma were 84.87% (7 d), 38.19% (7 d) and 100% (3 d), respectively. Crude proteins and lipopeptides extracted from STO-12 exhibited high antifungal activities against Alternaria tenuissima, Colletotrichum gloeosporioides and Cytospora chrysosperma and the hyphae at the edge of inhibition zones developed swelling. For crude proteins, the average diameters of the inhibition zones for Alternaria tenuissima, Colletotrichum gloeosporioides and Cytospora chrysosperma were 12.33, 9.50 and 16.50 mm, respectively. For lipopeptides, the average diameters of the inhibition zones were 17.50, 17.06 and 21.50 mm, respectively. STO-12 could produce cellulase and protease. Moreover, volatiles produced by STO-12 also could inhibit the hyphal growth of Alternaria tenuissima, Colletotrichum gloeosporioides and Cytospora chrysosperma, and the inhibition rates were 38.96% (3 d), 9.35% (3 d) and 82.14% (2 d), respectively. Our results suggested that Bacillus subtilis STO-12 had strong antifungal activity, varied antifungal substances and wide antifungal spectrum, had the potential prospect of industrial development and field application.
枯草芽孢杆菌(Bacillus subtilis)是一类重要的生防微生物, 广泛分布于自然界各种不同环境中, 在土壤、水体、植物体表面和植物体内普遍存在。枯草芽孢杆菌生长速度快、营养需求简单、具有较好的抗逆性、易于在植物体表面定殖与繁殖、抑菌谱广、对人畜无害、不污染环境, 且生产枯草芽孢杆菌制剂的工艺简单、制剂稳定、储存时间长、施用方便, 因此, 备受植物病害生物防治研究者的关注[1, 2]。枯草芽孢杆菌在国内外已经被广泛用于防治多种植物病害且很多已经商品化生产。枯草芽孢杆菌GBO3(商品名为Kodiak)由美国Gustafson公司开发, 能预防由镰刀菌属(Fusarium spp)、曲霉属(Aspergillus spp)、链格孢属(Alternaria spp)和丝核菌属(Rhizoctonia spp)引起的豆类、麦类、棉花和花生等根部病害[3]。枯草芽孢杆菌MBI 600(商品名为Subtilex)由美国Microbio Ltd公司开发, 能防治灰霉病、白粉病及由镰刀菌属(Fusarium spp)、曲霉属(Aspergillus spp)、丝核菌属(Rhizoctonia spp)引起的叶部和根部病害[4]。百抗(10 亿· g-1枯草芽孢杆菌B908可湿性粉剂)是由云南农业大学和中国农业大学共同研制的产品, 对水稻纹枯病的防治效果显著, 可达70%以上, 对烟草青枯病的防效可达到80%以上, 也是全国第一个在水稻上获得登记的芽孢杆菌杀菌剂[1, 2]。麦丰宁是南京农业大学利用枯草芽孢杆菌B3开发得到的活体生物杀菌剂, 对小麦纹枯病田间防效达50%~80%, 其主要通过产生抗菌物质来抑制小麦纹枯病菌菌丝生长、菌核形成和菌核萌发从而达到防病效果[1, 2]。
枯草芽孢杆菌防治植物病害的作用方式多种多样, 主要有拮抗作用、竞争作用、溶菌作用、诱导抗性和促进植物生长等[1, 2]。其中, 拮抗作用是枯草芽孢杆菌表现出较强抑菌活性的主要因素之一, 枯草芽孢杆菌通过产生抑菌物质抑制有害病原菌的生长、发展或直接杀死病原菌[5]。枯草芽孢杆菌能产生多种类型的抑菌物质, 主要通过2种途径, 分别为核糖体合成和非核糖体合成。核糖体合成的抑菌物质主要有活性蛋白类、酶类、细菌素等, 如鞭毛蛋白、枯草菌素(subtilin)、β -1, 3-葡聚糖酶和几丁质酶等; 非核糖体途径合成的抑菌物质主要有脂肽类、多肽类物质、挥发性抑菌物质等, 如表面活性素(surfactins)、伊枯草菌素(iturins)、丰原素(fengycins)、醇类、酮类、酚类等[1, 2, 6, 7, 8]。
枯草芽孢杆菌(Bacillus subtilis)STO-12是从健康的枣树根际土壤中分离得到的一株拮抗菌, 该菌株对枣缩果病菌(Alternaria tenuissima)具有显著的抑菌活性[9]。本研究通过进一步研究枯草芽孢杆菌STO-12对多种植物病原真菌的抑菌活性及其抑菌作用物质, 为该菌株及其抑菌物质的进一步开发和应用提供理论基础和科学依据。
枯草芽孢杆菌(Bacillus subtilis)STO-12由本实验分离和保存。供试植物病原真菌:枣缩果病菌(Alternaria tenuissima)、杨树炭疽病菌(Colletotrichum gloeosporioides)和杨树腐烂病菌(Cytospora chrysosperma)均由中国林业微生物菌种保藏管理中心(CFCC)提供。
LB培养基:用于芽孢杆菌的平板培养和斜面保存; PDA培养基:用于病原菌的培养和抑菌活性检测; LB液体培养基:用于芽孢杆菌种子液的制备; 优化培养基(葡萄糖22.64 g, 蛋白胨11.93 g, 大豆粉5.00 g, KH2PO4 1.00 g, MgSO4· 7H2O 0.50 g, NH4Cl 3.00 g, Na2HPO4 1.00 g, 酵母浸粉1.86 g, 蒸馏水定容至1 000 mL, pH 7.0~7.2)[10]:用于芽孢杆菌的发酵培养。
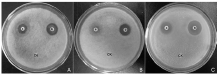
STO-12对植物病原真菌的拮抗作用采用平板对峙法测定[11]。在PDA平板(直径9 cm)中, 距平板中央左右各2.5 cm的地方平行划线接种活化培养的拮抗菌STO-12, 30 ℃倒置培养1 d, 然后在平板中央接种新鲜的病原真菌菌饼(6 mm), 28 ℃倒置培养。对照组是在未接拮抗菌的平板中央接种病原菌菌饼, 每个处理4次重复, 待对照组真菌菌丝铺满平板后, 测量处理组病原真菌和拮抗菌之间抑菌带的宽度。
挑取STO-12单菌落, 接种至盛有100 mL LB培养液的三角瓶中(规格250 mL), 于28 ℃、200 r· min-1振荡培养24 h得到STO-12种子液。按1% (V/V)接种量将种子液接入装有100 mL优化培养基的三角瓶(规格500 mL)中, 于28 ℃、200 r· min-1振荡培养4 d。4 ℃、10 000 g离心30 min后收集上清液, 再用0.22 μ m微孔滤膜过滤, 得到无菌培养滤液[11]。
无菌培养滤液抑菌活性的测定采用菌丝生长速率法[12]。将STO-12的无菌培养滤液以1:10 (V/V)的比例与加热冷却至40~50 ℃的PDA混合, 倒平板, 在不同的平板中央分别接入直径6 mm的病原真菌菌饼, 28 ℃倒置培养, 每隔1 d测量病原菌菌落直径, 直至对照组菌落直径长至培养皿直径的3/4以上为止。以不加STO-12无菌滤液的平板作为对照, 每个处理设4个重复, 采用十字交叉法测量病原菌菌落直径, 计算相对抑菌率。相对抑菌率(%)=[(对照组扩展直径-处理组扩展直径)/对照组扩展直径]× 100。
按照1.4节的方法获得STO-12的无菌培养滤液, 往无菌培养滤液中加入硫酸铵至60%的饱和度, 振荡混匀, 于4 ℃静置过夜。4 ℃、10 000 g离心30 min后收集沉淀, 将沉淀溶于少量蒸馏水中, 再置于透析袋(8 000~14 000 u)中透析脱盐, 透析后调节蛋白粗提液的pH为7.0。最后将透析得到的蛋白粗提液冷冻抽干, 获得蛋白类提取物[11, 13]。用无菌水将蛋白类提取物配制成8.0 mg· mL-1蛋白液, 4 ℃保存备用。采用考马斯亮蓝G250染色法[14], 以牛血清蛋白(BSA, sigma产品)为标准蛋白, 测定蛋白液的蛋白质含量。
蛋白类提取物的抑菌活性测定采用滤纸片法[15]。用无菌水从产孢的植物病原真菌平板上冲洗孢子, 将孢子浓度配成1 × 105 cfu· mL-1, 然后将配好浓度的孢子液以1:10 (V/V)的比例与加热冷却至40~50 ℃的PDA混合, 倒平板, 待平板冷却凝固后, 将无菌的6 mm滤纸片置于平板上, 采用逐滴滴加的方法往滤纸片上滴加40 μ L的8.0 mg· mL-1蛋白液, 28 ℃倒置培养, 每个处理重复4次。待菌丝长满皿后测定抑菌圈的大小, 并挑取抑菌圈边缘菌丝观察蛋白类提取物对病原真菌菌丝的影响。
按照1.4节中的方法获得STO-12的无菌培养滤液, 用6.0 mol· L-1的盐酸调节无菌培养滤液的pH至2.0, 于4 ℃静置过夜。4 ℃、10 000 g离心30 min后收集沉淀, 将沉淀溶解在无菌水中并用1.0 mol· L-1的氢氧化钠溶液pH调至中性, 冻干溶液获得干燥物。用甲醇萃取干燥物3次, 合并萃取液, 然后在旋转蒸发仪中减压蒸干得到脂肽类提取物[16]。用无菌水将脂肽类提取物配制成8.0 mg· mL-1脂肽液, 4 ℃保存备用。
脂肽类提取物抑菌活性的测定采用1.5节的方法, 同时挑取抑菌圈边缘菌丝观察脂肽类提取物对病原真菌菌丝的影响。
β -1, 3-葡聚糖酶、几丁质酶、纤维素酶、蛋白酶和脂酶的检测分别采用文献[17-20]的方法。
采用二分皿法测定挥发性气体的抑菌活性[12]。待对照组菌落直径达到培养皿直径一半的3/4以上时, 测量菌落直径, 计算相对抑菌率。相对抑菌率=[(对照组扩展直径-处理组扩展直径)/对照组扩展直径]× 100%。
对峙培养试验结果表明, 菌株STO-12对枣缩果病菌、杨树炭疽病菌和杨树腐烂病菌均具有很好的拮抗作用, 拮抗作用所形成的抑菌带宽度分别达到12.67、9.67和13.50 mm。
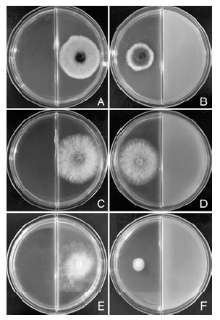
STO-12无菌培养滤液对3种病原真菌的抑菌活性测定结果显示, STO-12的无菌培养滤液均能明显抑制枣缩果病菌、杨树炭疽病菌和杨树腐烂病菌菌丝的生长(表1, 图1)。而且, 连续观察发现, STO-12无菌滤液对枣缩果病菌的抑菌活性随着培养时间的延长呈先增大后减小的趋势, 但始终保持较高的抑菌活性水平, 培养7 d后对枣缩果病菌的抑菌率依然达84.87%(图1-A, B); STO-12无菌滤液对杨树炭疽病菌的抑菌活性随着培养时间的延长而逐渐降低, 培养1 d后其抑菌率最高达到55.81%, 而培养7 d后其抑菌率降低为38.19%(图1-C, D); 无菌滤液能完全抑制杨树腐烂病菌的生长且抑菌活性稳定, 培养3 d后抑菌率依然达100%(图1-E, F)。
| 表1 枯草芽孢杆菌STO-12无菌培养滤液的抑菌活性 Table 1 Antifungal activities of sterile culture filtrate of Bacillus subtilis STO-12 % |
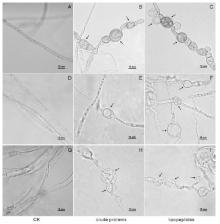
STO-12蛋白类和脂肽类提取物的抑菌活性检测结果表明, STO-12蛋白类和脂肽类提取物均具有较好的抑菌活性(图2)。其中8.0 mg· mL-1(蛋白质浓度为 418.625 μ g· mL-1)的蛋白类提取物抑制枣缩果病菌、杨树炭疽病菌和杨树腐烂病菌菌丝生长所形成的抑菌圈直径分别为12.33、9.50和16.50 mm; 同样浓度的脂肽类提取物抑制这3种病原真菌所形成的抑菌圈直径分别为17.50、17.06和21.50 mm。另外, 通过观察抑菌圈边缘的菌丝发现, 3种病原真菌经过蛋白类(图3-B, E, H)和脂肽类(图3-C, F, I)提取物作用后的菌丝产生局部膨大的畸形结构, 而未处理的对照组(图3-A, D, G)菌丝生长正常、形态均匀。
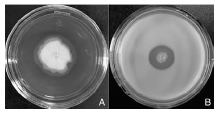
细胞裂解酶特性的检测结果显示, 只有纤维素酶(图4-A)和蛋白酶(图4-B)的检测平板中菌体周围产生透明圈, 而其他裂解酶检测的平板中菌体周围未见透明圈或晕圈出现, 说明STO-12能产生纤维素酶和蛋白酶, 而不能产生几丁质酶、β -1, 3-葡聚糖酶和脂酶。
由图5可知, STO-12的挥发性气体对枣缩果病菌、杨树炭疽病菌和杨树腐烂病菌的菌丝生长均有抑制作用, 其中, 挥发性气体对杨树腐烂病菌的抑菌效果最好(图5-E, F), 培养2 d后其抑制率达到82.14%; 对枣缩果病菌也有较好的抑制效果(图5-A, B), 培养3 d后其抑制率达到38.96%; 对杨树炭疽病菌的抑制效果较差(图5-C, D), 培养3 d后其抑制率只有9.35%。
枯草芽孢杆菌是自然界中很重要的一类抑菌活性强且抑菌谱广的生防菌, 能抑制多种植物病原菌, 包括链格孢属(Alternaria spp)、曲霉属(Aspergillus spp)、念珠菌属(Monilia spp)、镰刀菌属(Fusarium spp)、疫霉属(Phytophthora spp)、丝核菌属(Rhizoctonia spp)、座坚壳属(Rosellinia spp)、菊文氏菌(Dickeya spp)、葡萄球菌(Staphylococcus spp)、假单胞菌(Pseudomonas spp)、欧文氏菌(Erwinia spp)、黄杆菌属(Xanthomonas spp)等[21, 22, 23]。本研究中的枯草芽孢杆菌STO-12菌株及其无菌培养滤液对枣缩果病菌(Alternaria tenuissima)、杨树炭疽病菌(Colletotrichum gloeosporioides)和杨树腐烂病菌(Cytospora chrysosperma)均具有很好的抑菌活性, 其中, STO-12的无菌培养滤液对这3种病原菌的平板抑制率分别为84.87%(7 d)、38.19%(7 d)和100%(3 d)。
枯草芽孢杆菌在生长代谢过程中会产生很多种类的抑菌活性物质, 这些抑菌物质的产生是枯草芽孢杆菌表现较高抑菌活性和较广抑菌谱的重要原因之一[1, 2]。由非核糖体途径合成的脂肽类抑菌物质是枯草芽孢杆菌产生的主要抑菌活性物质之一[7]。大量研究表明, 枯草芽孢杆菌能产生多种类型的脂肽类抑菌物质(如surfactin、iturin和fengycin), 从而抑制植物病原菌的生长并导致病原菌的菌丝畸形[24, 25]。由核糖体途径合成的蛋白类抑菌物质也是枯草芽孢杆菌产生的一种重要的抑菌物质, 这些蛋白类抑菌物质多为细胞壁裂解酶类物质, 如几丁质酶、纤维素酶、蛋白酶、脂肪酶和β -1, 3-葡聚糖酶。这些细胞壁裂解酶的作用机制是通过裂解病原菌细胞壁, 导致病原菌细胞裂解, 从而导致病原菌细胞死亡[26, 27]。大部分生防枯草芽孢杆菌都能产生一种或多种细胞壁裂解酶[12, 27]。此外, 枯草芽孢杆菌产生的蛋白类抑菌物质还包括其他的一些多肽和蛋白[6, 28]。本研究中的枯草芽孢杆菌STO-12的脂肽类物质和蛋白类物质对3种病原真菌(枣缩果病菌、杨树炭疽病菌和杨树腐烂病菌)均具有较好的抑菌活性, 同时, 也发现STO-12脂肽类和蛋白类物质也能导致这3种病原真菌的菌丝产生局部膨大畸形。另外, 枯草芽孢杆菌STO-12还能分泌蛋白酶和纤维素酶, 这可能是STO-12蛋白类物质使菌丝产生膨大畸形的主要原因之一, 也是STO-12能抑制多种病原真菌的重要原因之一。
很多生防微生物在生长代谢过程中还会产生一些挥发性抑菌气体, 包括真菌、酵母、放线菌和细菌。生防菌产生的这些挥发性气体种类繁多, 主要包括醇类、醛类、酸类、脂类和酮类等化合物[8, 29]。很多枯草芽孢杆菌也能产生挥发性抑菌气体, 这些抑菌挥发性气体能对多种植物病原菌产生抑制作用, 如核盘菌(Sclerotinia sclerotiorum)、灰葡萄孢菌(Botrytis cinerea)、菊池氏尾孢菌(Cercospora kikuchii)、芸苔链格孢(Alternaria brassicae)、球虫念珠菌(Moniliophthora perniciosa)、黄曲霉(Aspergillus flavus)、寄生曲霉(Aspergillus parasiticus)、黑曲霉(Aspergillus niger)、尖孢镰刀菌(Fusarium oxysporum)、棒曲霉(Aspergillus clavatus)、大丽轮枝菌(Verticillium dahliae)等[12, 29, 30]。本研究结果表明, 枯草芽孢杆菌STO-12的挥发性气体也具有一定的抑菌效果, 其对3种不同的病原菌具有不同的抑菌活性, 对杨树腐烂病菌的抑抑制作用最好, 抑菌率达到82.14%。
本研究对枯草芽孢杆菌STO-12的抑菌活性及其抑菌物质进行了初步的分析, 研究结果表明, STO-12的菌株及其无菌培养滤液均能抑制多种植物病原真菌; STO-12能产生蛋白类、脂肽类及挥发性气体等抑菌活性物质, 且蛋白类和脂肽类抑菌活性物质能导致病原真菌的菌丝产生膨大的畸形结构; 此外, 还明确了STO-12能产生纤维素酶和蛋白酶2种细胞壁裂解酶, 显示出了较高的研究和应用价值。目前, 枯草芽孢杆菌STO-12的抑菌活性物质的具体种类结构、特性及其抑菌机理还不清楚, 需要后续进一步研究与探索。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|