作者简介:魏斌(1992—),女,山西平遥人,硕士研究生,从事兽医临床病理学与分子诊断学。E-mail:865360412@qq.com
为建立一种不提取病毒RNA,直接采用TaqMan荧光定量RT-PCR检测样本上清液中犬瘟热病毒的方法。通过扩增CDV的 NP基因部分片段构建重组质粒,建立TaqMan荧光定量PCR方法,对所建立的方法进行特异性、敏感性、重复性检测;比较了提取核酸后进行荧光定量RT-PCR与不提取核酸对原液进行荧光定量RT-PCR检测的结果,最后对疑似CDV病料进行检测。结果显示,建立的CDV质粒TaqMan荧光定量PCR检测灵敏度比普通PCR灵敏度高1 000倍。将核酸提取液和病毒原液稀释后用该研究建立的方法进行检测,最小检测稀释倍数分别为107和105,表明提取核酸后样本中的有效cDNA浓度比直接使用病毒原液检测高100倍。特异性和重复性检测结果表明,该方法特异性良好且重复性较高。对97份临床病料进行检测,建立的方法共检出60份阳性,阳性检出率高于普通RT-PCR和胶体金快速检测试纸板,提取核酸法与原液法的一致率为100%。标准曲线分析表明,当病毒含量高于102拷贝·μL-1时,与普通RT-PCR以及胶体金快速检测试纸板相比,CDV原液TaqMan荧光定量RT-PCR检测技术阳性检出率更高、准确性更好,值得临床推广应用。
To establish a direct TaqMan fluorescent quantitative RT-PCR (direct-qRT-PCR) method without extracting nucleic acid for detecting canine distemper virus(CDV). Specificity, sensitivity and reproducibility of the method were tested by using constructed recombinant plasmid. Fluorescence quantitative RT-PCR was used to compare the detection limitation in both the nucleic acid extraction and the viral stock. Clinical samples were also collected and applied for verification the established method. Our results showed that the sensitivity of this method was 1 000 times higher than ordinary PCR. Nucleic acid extraction and viral stock was detected by the established method, the minimum detectable dilution times were 107 and 105, respectively, indicated that the effective cDNA concentration in the sample after nucleic acid extraction was 100 times higher than that using viral stock to test. Specificity and reproducibility results showed that the method had good specificity and reproducibility. 97 clinical samples were detected by this method, 60 samples showed positive. The detectable rate of this method was higher than those of ordinary RT-PCR and colloidal gold rapid detection plate. The positive detectable rate using nucleic acid extraction was perfectly matched with that using viral stock. Compared with ordinary RT-PCR and colloidal gold rapid detection plate, standard curve showed direct-qRT-PCR had high accuracy and positive detectable rate while the virus concentration was higher than 102 copies·μL-1, and it was worthy of clinical application.
犬瘟热(canine distemper, CD)是由犬瘟热病毒(canine distemper virus, CDV)引起的一种对宠物犬以及经济毛皮动物(貂、狐)等造成严重危害的疾病。该病呈世界性分布, 死亡率达80%~90%, 1997年《中华人民共和国动物防疫法》将其列为三类动物疫病[1]。研究发现, CD的发生率随着人口的增加逐年增加[2]。CDV在中国的感染率也呈上升趋势, 近年来, 在江苏、四川、黑龙江、云南等地均有CDV流行的报道[3, 4, 5, 6]。CDV不仅可感染犬, 还可感染浣熊、大熊猫以及灵长类动物猴子等[3.5.7, 8, 9]。有试验表明, CDV可感染人源细胞, 提示CDV存在感染人的潜在风险[10]。因此, 对CDV的准确诊断在临床中具有重要意义。
目前, 中国临床中对CDV的检测主要以兽医师经验诊断以及胶体金快速检测试纸板为主, 但犬冠状病毒、犬轮状病毒、犬腺病毒-1型和犬腺病毒-2型在犬中也可引起同犬瘟热一样的症状, 胶体金快速检测试纸板的准确性低且易出现假阳性, 导致临床诊断出现误差, 需要借助实验室诊断进行确诊[11, 12, 13, 14, 15]。目前, CDV常用的实验室检查技术主要包括ELISA、血清中和试验、病毒的分离培养以及RT-PCR[16], 但是这些方法均易受影响且灵敏性较低[17]。RT-PCR扩增是CDV常用的实验室检测方法, 常规RT-PCR方法操作复杂耗时长, 临床样品中的一些抑制剂会对其产生影响且特异性较低[18]。因此, 建立一种简单、快速、准确检测CDV的方法具有重要意义。
荧光定量RT-PCR由于其检测的准确性和操作的简便性逐渐成为代替普通RT-PCR对病毒进行检测的方法。TaqMan荧光定量RT-PCR已广泛用于猫细小病毒、犬细小病毒(canine parvo virus, CPV)和CDV等病原的检测[16, 17, 19]。近年来, 有学者尝试使用TaqMan实时荧光定量PCR对临床中的病原进行检测, 整个检测过程不提取核酸以提高检测效率和减少检测成本[20, 21, 22, 23, 24, 25]。本试验尝试建立一种直接采用临床样本原液检测CDV的TaqMan荧光定量RT-PCR技术, 检测过程不提取样本核酸, 为临床快速准确诊断CDV提供新的方法。
CDV阳性株、犬狂犬病病毒(Rabies virus, RABV)阳性株、犬腺病毒Ⅰ 型(Canine Adenovirus Type 1, CAV-1)阳性株、犬腺病毒Ⅱ 型(Canine Adenovirus Type 2, CAV-2)阳性株、犬副流感病毒(Canine parainfluenza virus, CPIV)阳性株(CPIV/A-20-8)、CPV阳性株均由本课题组分离鉴定并保存[26]。CDV在Vero细胞中培养, 细胞培养基选用DMEM(Dulbecco’ s modified Eagle’ s medium; Sigma, Saint Louis, Mo, USA)。
病毒RNA/DNA小量提取试剂盒购自美国Invitrogen公司, 核酸凝胶回收试剂盒及高纯质粒小量制备试剂盒购自厚生生物科技有限公司, pEASY-T1 Simple Cloning Vector购自北京全式金生物技术有限公司, 荧光定量PCR反应试剂盒(one step probe PCR master mix)和大肠埃希菌DH5α 感受态细胞购自天根生化科技(北京)有限公司, 核酸染料、琼脂糖、生化试剂等购自生工生物工程(上海)股份有限公司, 阳性对照为本课题组分离保存的CDV毒株核酸, 阴性对照为无菌水。
97份病料取自四川农业大学兽医院门诊病例中疑似犬CDV的病例, 将其口鼻分泌物及尿液混于装有1.0 mL PBS的1.5 mL离心管中, 震荡混匀后, 5 000 g离心5 min, 收集上清备用。所有临床样本采集后置于-70 ℃保存备用。
文中所涉及的相关病毒核酸, 均使用病毒核酸提取试剂盒从200 μ L细胞培养液或临床病料提取, 提取后的核酸置于-70 ℃保存。
对Gen Bank提交的CDV核衣壳蛋白(NP)基因序列(基因登录号:KJ466106)进行比对, 设计CDV荧光定量RT-PCR引物和TaqMan通用探针。引物序列分别为qPCR-F: 5’ - AGGTCTCGACTATTGGATAGACTT-3’ , qPCR-R: 5’ -CGAACAAGGAGAGGATACTGAT-3’ , 探针为qPCR-probe: FAM-5’ -ATTGGTTGGTGATCCGAAAATCAAC-3’ -BHQ1, 扩增片段长度为100 bp。引物和探针均由生工生物工程(上海)股份有限公司合成。
按照病毒RNA/DNA小量提取试剂盒说明书提取CDV阳性毒株RNA, 然后以RNA为模板, 使用RT-PCR特异性引物进行RT-PCR扩增。25 μ L CDV RT-PCR反应体系:Master Mix 12.5 μ L, RNA模板2.0 μ L, 上、下游引物(10 μ mol· L-1)各1.0 μ L, Quant RTase 0.4 μ L, ddH2O 8.1 μ L。反应条件:50 ℃反转录30 min, 92 ℃逆转录酶失活3 min; 92 ℃ 10 s, 55 ℃ 20 s, 68 ℃ 20 s, 40个循环; 68 ℃ 7 min。用10 g· L-1的琼脂糖凝胶电泳对产物进行鉴定。
回收100 bp的NP基因片段, 将回收产物和pEASY-T1 Simple载体连接, 转入DH5α 大肠埃希菌感受态细胞, 菌液过夜培养后挑取单菌落, 菌落进行振荡培养并提取质粒。PCR鉴定重组质粒, 测序正确的阳性重组质粒作为本试验CDV质粒荧光定量PCR方法的标准品。用核酸测定仪对该标准品进行浓度测定。
将CDV重组质粒标准品进行10倍倍比稀释(10~107), 以此为模板进行荧光定量PCR扩增。25 μ L CDV质粒PCR反应体系:2× Taq PCR Master Mix 12.5 μ L, 质粒模板2.0 μ L, 上、下游引物(10 μ mol· L-1)各0.5 μ L, 探针(5 μ mol· L-1)1.0 μ L, HotMaster Taq polymerase 1.0 μ L, ddH2O 7.5 μ L。反应条件:92 ℃ 3 min; 92 ℃ 10 s, 55 ℃ 20 s; 68 ℃ 20 s, 40个循环, 68 ℃ 7 min。以质粒浓度为横坐标, 以Ct值为纵坐标, 制作标准曲线。
以CDV阳性株、RABV阳性株、CAV-Ⅰ 阳性株、CAV-Ⅱ 阳性株、CPIV阳性株、CPV阳性株的核酸为模板, 病毒培养液为阴性对照, 对模板进行50 ℃反转录30 min。然后用1.6节的方法进行检测, 以检测该方法的特异性。
将CDV重组质粒进行10倍倍比稀释后作为模板, 用所建立的方法和普通PCR方法进行检测, 检测该方法的敏感性。
将CDV阳性质粒标准品进行稀释, 取同一批次3个不同梯度(稀释倍数102、104、106)的标准品为模板, 用所建立的方法进行组内和组间重复性试验, 并计算其组内及组间变异系数, 评价该方法的重复性。
将CDV病毒培养液上清及其核酸10倍倍比稀释后, 用所建立的方法进行检测。25 μ L CDV RT-PCR反应体系:2× Quant One Step Probe qRT-PCR Master Mix 12.5 μ L, 病毒培养液上清或RNA模板2.0 μ L, 上、下游引物(10 μ mol· L-1)各0.5 μ L, 探针(5 μ mol· L-1)1.0 μ L, HotMaster Taq polymerase 1.0 μ L, Quant RTase 0.4 μ L, ddH2O 7.1 μ L, 反应条件:50 ℃反转录30 min, 92 ℃逆转录酶失活3 min; 92 ℃ 10 s, 55 ℃ 20 s; 68 ℃ 20 s, 40个循环; 68 ℃ 7 min。比较原液及核酸的初始核酸浓度差异及两者的最小检测浓度。
将收集的97份疑似CDV临床样品分别使用胶体金快速检测试纸板、普通RT-PCR、荧光定量RT-PCR及本研究建立的荧光定量RT-PCR进行检测, 设置阳性对照和阴性对照, 对检测结果进行比较。
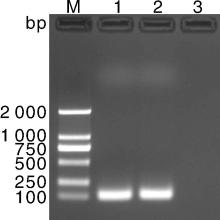
CDV阳性毒株提取RNA后进行RT-PCR扩增, 扩增出预期目标大小产物。产物经胶回收、连接、转化、阳性克隆菌培养、提取质粒后, 经PCR、酶切鉴定及测序, 成功构建了重组质粒标准品(图1)。经测定, 该质粒标准品的浓度为4.20× 108 拷贝· μ L-1。
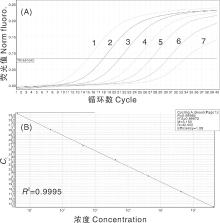
CDV重组质粒标准品进行10倍连续梯度稀释后进行荧光定量PCR扩增, 得到相应的动力学曲线(图2-A)和标准曲线(图2-B), 核酸初始模板浓度与Ct值呈现良好的线性关系, 决定系数R2=0.999 5。
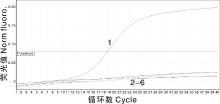
利用所建立的方法检测RABV、CPIV、CAV-Ⅰ 、CAV-Ⅱ 、CPV及CDV核酸, 结果(图3)显示, 只有CDV核酸出现扩增曲线, 其余病毒均无特异性扩增信号, 表明该方法检测CDV的特异性较好。
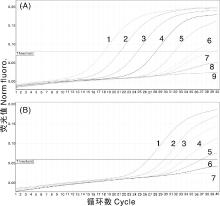
将CDV重组质粒进行10倍连续梯度稀释后, 用所建立的方法进行检测。结果表明, 该方法可检测出稀释至107的CDV模板(图4-A), 其最低检出浓度为10拷贝· μ L-1, 而普通PCR仅能检出104拷贝· μ L-1(图4-B), 表明CDV质粒荧光定量PCR比普通PCR的敏感性高1 000倍以上。
取CDV标准质粒的3个不同梯度(4.2× 106、4.2× 104、4.2× 102 拷贝· μ L-1)为模板进行批内及批间试验, 每个样品重复3次。结果显示, CDV批内及批间变异系数均小于1.2%(表1), 说明CDV荧光定量PCR重复性好, 可进行稳定、可靠的检测。
| 表1 CDV标准质粒荧光定量PCR的重复性 Table 1 Intra-batch and inter-batch coefficient variant (CV) of the TaqMan fluorescent quantitative PCR for CDV |
上述建立的CDV质粒荧光定量PCR检测结果显示, 提取的CDV核酸浓度约为6.23× 108 拷贝· μ L-1, CDV病毒原液浓度约为2.28× 106 拷贝· μ L-1, 提取核酸后其样本中的有效cDNA浓度比直接使用病毒原液进行检测提高了100倍。由图5可知, CDV核酸的最低检出浓度约为9.56× 10拷贝· μ L-1(稀释107倍), CDV病毒原液的最低检出浓度约为7.77× 10拷贝· μ L-1(稀释105倍)。结合CDV核酸与病毒原液浓度可知, 采用本研究建立的方法, 病毒原液的检测灵敏度高于CDV核酸样本。
用CDV原液荧光定量PCR方法对采集的97份临床病料原液进行检测, 并且与胶体金快速检测试纸板、普通RT-PCR以及核酸荧光定量RT-PCR进行比较。结果显示, 胶体金快速检测试纸板、普通RT-PCR、核酸荧光定量RT-PCR和原液荧光定量RT-PCR方法检测CDV阳性结果分别为:31份(31.96%)、43份(44.33%)、60份(61.86%)、60份(61.86%)。由此可知, 核酸荧光定量RT-PCR和原液荧光定量RT-PCR均表现出较高的阳性检出率。进一步分析发现, 胶体金快速检测试纸板检测的31份阳性样品, 原液荧光定量RT-PCR均检测为阳性; 普通RT-PCR检测的43份阳性样品, 原液荧光定量RT-PCR均检测为阳性; 核酸荧光定量RT-PCR和原液荧光定量RT-PCR的检测结果完全一致, 60份样品均检测为阳性。胶体金快速检测试纸板检测的66份阴性样品中, 常规RT-PCR检测出54份阴性, 而核酸荧光定量RT-PCR和原液荧光定量RT-PCR均检测出37份阴性, 表明原液荧光定量RT-PCR和核酸荧光定量RT-PCR比胶体金快速检测试纸板、常规RT-PCR的检出率高, 且结果准确可靠。
CDV检测方法众多, 既包括病毒的分离培养、电镜观察, 也包括以胶体金快速检测试纸板为代表的免疫学检测技术, 同时RT-PCR、斑点杂交技术
近年来, 一种不提取病毒核酸的TaqMan荧光定量(RT-)PCR检测病原的方法陆续被报道, 该方法省时、易操作。Nakamichi等[33]采用不提取核酸的荧光定量PCR方法对JCV病毒(John cunningham polyomavirus)进行检测, 发现该方法可检测的病毒含量为103拷贝· μ L-1; Ihira等[34]采用不提取病毒DNA建立的环介导等温扩增方法对人6型疱疹病毒(Human herpesvirus 6)进行检测, 结果表明, 该方法可检测的病毒量为10拷贝· tube-1; Baethgen等[23]使用不提取核酸PCR方法直接检测脑膜炎球菌, 结果显示最小检测量为2× 102 cfu· mL-1; Nishimura等[24]使用不提取核酸的荧光RT-PCR对诺如病毒(Norovirus)进行检测, 该方法可检测的GII/4及基因型未定的GII病毒含量分别为106、105 拷贝· g-1。以上研究均表明, 不提取核酸的荧光定量(RT-)PCR用于临床样品中的病毒以及细菌的检测是一种切实可行的方法。
基于以上研究, 本试验首次采用病毒上清液直接对CDV进行荧光定量RT-PCR检测。所建立的CDV质粒荧光定量PCR方法在相同稀释浓度下敏感性和特异性更高, 重复性好, 敏感性可达10拷贝· μ L-1, 检测灵敏度比普通PCR高1 000倍, 并且对CPV、CAV-1、CAV-2、RABV以及CPIV无扩增, 批内及批间变异系数均小于1.2%, 表明检测结果可靠稳定。CDV核酸及病毒原液荧光定量RT-PCR比较结果显示, 提取核酸后样本中有效cDNA浓度比直接使用病毒原液检测高100倍, 当样本中病毒含量高于102拷贝· μ L-1时, 本试验建立的方法能检测出样本中的CDV。CDV临床样本进行检测结果表明, 荧光定量RT-PCR在10~107 拷贝· μ 具有良好的线性关系, 实用性较强。对97份临床样本的病毒原液进行病毒含量检测, 与标准曲线对比后发现, 样本原液中的CDV含量均高于103拷贝· μ , 表明本试验建立的CDV原液TaqMan荧光定量RT-PCR检测方便、省时且特异性高。当病毒含量高于102拷贝· μ L-1时, 本试验所建立的CDV原液TaqMan荧光定量RT-PCR检测与胶体金检测法和普通RT-PCR法相比, 具有更高的阳性检出率, 可用于临床检测和实验室病毒鉴定。原液荧光定量RT-PCR与核酸荧光定量RT-PCR检测结果完全一致, 表明在CDV的定性检测中可直接使用所采集的病料原液进行荧光定量RT-PCR检测。
本试验中, 我们对临床样本或病毒培养液上清的CDV进行检测。结果表明, 对样本原液或病毒培养液上清采用不提取核酸的荧光定量RT-PCR检测CDV是可行的。笔者认为不提取核酸能直接检测出CDV病毒, 原因可能有以下几种:首先, 临床采集的样本或病毒培养液中存在从细胞中溢出的病毒核酸以及细胞死亡后释放的病毒核酸; 其次, 样本在处理过程中进行了高速离心5 min的步骤, 此过程可能导致了病毒核酸的部分释放; 最后, TaqMan探针荧光定量RT-PCR具有非常高的检测灵敏度, 本试验结果表明检测灵敏度可达10拷贝· μ L-1数量级。
综上所述, 与常规RT-PCR、胶体金快速检测试纸板相比, 本研究建立的不提取核酸荧光定量RT-PCR法检测结果与提取核酸后进行RT-PCR检测结果相一致。敏感性和特异性试验表明, 所建立的方法能用于临床样本的检测, 操作简便省时, 对于CDV的早期诊断、预防控制等具有重要意义。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|