作者简介:邓振山(1969—),男,陕西黄陵人,博士,副教授,主要从事微生物资源与利用和环境微生物学研究。E-mail:zhenshandeng214@163.com
采用组织分离法和研磨涂布法筛菌以及对峙培养法进行抑菌试验,C-22-1菌株的发酵液经过反复萃取分离得到有抗菌活性的物质,以抑菌圈大小为指标对C-22-1菌株发酵条件中的碳源、氮源和发酵时间进行单因素优化。C-22-1菌株发酵液及其活性物质对7种人体常见致病菌抑菌活性测定显示,C-22-1菌株发酵液对白色葡萄球菌( Staphylococcus albus)的抑菌圈直径达29 mm,定性试验显示菌株C-22-1产皂苷类物质,单因素优化结果表明,菌株C-22-1的最佳碳源、氮源、时间分别是葡萄糖、酵母膏、8 d。初步确定C-22-1菌株可产抗菌活性物质为三萜皂苷。
Using tissue separation and grinding coated method, the endophytes were screened out to study the active substances in the leaves of wild jujube endophytic microbes and species identification, and the filter method was used to test the antibacterial activities. The fermented product extraction of strain C-22-1 was extracted again and again to gain the antimicrobial substances. The single fermentation conditions of strain C-22-1, including carbon source, nitrogen source and time, were optimized according to the size of inhibition zone. The antibacterial activities of fermented liquid of C-22-1 and the antimicrobial substances were detected to seven human common pathogenic bacteria; the strain C-22-1’s antibacterial circle diameter reached 29 mm to Staphylococcus albus. Qualitative test showed the strain C-22-1 produce saponins. Single factor optimization results showed that best carbon, nitrogen source and time was glucose, yeast extract and 8 d, respectively. Strain C-22-1 produce antimicrobial substances, which was initially identified as triterpenoid saponins.
植物体内普遍存在着内生菌, 植物内生菌(endophyte)是指整个生活史或者是生活史中的某一阶段能够定殖在宿主植物健康细胞内或者细胞之间, 却不对其宿主产生病害症状的微生物[1, 2], 可寄存在植物的根、茎、叶、花、果实及种子中。近年来, 颜华等[3]、郑艳等[4]、刘莹等[5]、刘胜贵等[6]众多学者从经济林木、药用植物、杂草等植物中分离到大量的内生菌, 2010年黄海东等[7]从云雾龙胆中分离得到一株内生细菌, 它的发酵液对金黄色葡萄球菌和大肠埃希菌有抑菌效果。
酸枣[Ziziphus jujuba Mill. var. spinosa(Bunge)Hu ex H.F.Chow.]为鼠李科, 广泛分布于我国中、北部地区, 抗逆性强, 是一种耐旱、耐寒、耐盐碱的野生药用植物。酸枣素有“ 天然维生素丸” 之称, 此外酸枣还具有养心安神、补肝、敛汗的功效, 主治心烦失眠、惊悸怔忡、体虚多汗、神经衰弱、多梦、汗少口干等症状。孙延芳等[8]发现酸枣中有酒石酸、柠檬酸、草酸等, 有学者发现酸枣果肉中含有多种三萜类化合物[9, 10]如蛇滕酸、麦珠子酸等。王向红等[11]分析发现多种枣中的齐墩果酸和熊果酸的含量均显著低于酸枣。
酸枣中有很多活性物质, 1997年, 首次从酸枣仁中分离得到黄酮类化合物[12], 曾路等[13]分离得到了斯皮诺素和酸枣黄素两种黄酮类物质以及酸枣仁皂苷A、B(jujubosides A、B)。有研究表明, 酸枣仁中的黄酮类化合物还有药黄素[14]、当药素(swertisin)、异斯皮诺素(isospinosin)、6″-对香豆酰斯皮诺素(6″-p-coumaroylspinsin)[15]、异牡荆素(isovitexin)[16]、槲皮素(quercetin)[17]。酸枣仁中含有的皂苷类物质有酸枣仁皂苷A1、B1、C[18]、D[19], 羽扇环烷型三萜类化合物有罗珠子酸甲酯。
目前对酸枣的研究也很多, 但对酸枣内生菌的研究较少, 目前仅刘东[20]、高振峰等[21]分别从山西酸枣体内分离获得76株内生细菌和40株内生真菌, 但有关陕北酸枣内生菌的研究鲜有报道。鉴于此, 本研究从陕北酸枣叶片筛选内生菌, 通过生物活性测定的方法选出有抑菌作用的菌株, 并对其内生菌的次生代谢产物进行初步研究。
1.1.1 材料的采集
酸枣[Zizyphus jujuba Mill.var.spinosa(Bunge)Hu]植株于2015年5月采自延安大学后山、延安凤凰山(不带根), 采样后立即带回实验室供当天试验使用, 剩余的叶片置于4 ℃冰箱备用。
1.1.2 指示菌株
指示菌株均来于延安大学医学院, 由延安大学生命科学学院微生物实验室保藏, 指示菌编号见表1。
| 表1 指示菌株编号 Table 1 Indicator strain number |
1.1.3 培养基
筛选培养基:(1)PDA培养基; (2)牛肉膏培养基; (3)高氏培养基; (4)改良培养基1:叶片煮沸滤液1 000 g、NaCl 5 g、蔗糖10 g、琼脂18 g、pH 自然; (5)改良培养基2:NaCl 1 g、CaCl2 0.5 g、K2HPO4 0.5 g、FeCl3 0.02 g、(NH4)2SO4 1 g、MgSO4· 7H2O 1 g, 蒸馏水1 000 mL、pH 7.0~7.2;
发酵培养基:马铃薯200 g、葡萄糖20 g、蛋白胨10 g 、NaCl 5 g、MgSO4 5 g、K2HPO4 1 g、蒸馏水1 000 mL、pH自然;
优化培养基:(1)碳源筛选用基础培养基(g· L-1):各种碳源3 g、蛋白胨10 g、K2HPO4 3 g、MgSO4· 7H2O 1 g, 蒸馏水1 000 mL、pH自然。(2)氮源筛选用基础培养基(g· L-1):葡萄糖3 g、各种氮源10 g、K2HPO4 3 g、MgSO4· 7H2O 1 g, 蒸馏水1 000 mL、pH自然。
1.2.1 酸枣叶片内生菌的筛选
采集新鲜野生酸枣叶片用自来水冲洗, 在无菌条件下, 用无菌滤纸吸干水分, 操作为:无菌条件下95%乙醇中浸泡3 min→ 无菌水冲洗2次→ 0.1%升汞浸泡3 min→ 75%乙醇浸泡30 s→ 无菌水冲洗4~6次, 接着按以下两种方法进行试验:(1)组织分离法:无菌刀片将叶片切成大小为0.5 cm块, 接种于5种培养基平板上。(2)研磨涂布法:将材料放入无菌研钵中并加入5 mL无菌水研磨, 静置10 min, 取其上层液和残渣, 分别涂布于5种培养基平板上, 以上各处理均重复3次, 接种后的培养基分别放置在28 ° C和32 ° C的恒温培养箱中培养5~7 d, 同时取最后1次冲洗液涂布于PDA培养基平板上, 作为对照, 如对照平板无菌长出即表明消毒彻底, 则筛选的菌为酸枣体的内生菌。待观察到实验材料边缘有菌长出, 根据颜色和形态的差异挑取不同菌落, 四区划线纯化, 直至得到单菌落, 斜面保存备用。
1.2.2 内生菌抑菌活性测定
挑取备用斜面上的菌种复壮, 无菌条件下取直径为10 mm的复壮菌株的菌饼3~5个, 接种于已灭菌的PDA液体培养基中, 置于32 ℃恒温振荡培养器中以160 r· min-1培养18~24 h。无菌条件下, 用无菌棉签将致病菌株涂满牛肉膏固体培养基, 接着用直径10 mm的无菌打孔器在涂满致病菌的培养基上打孔并注入内生菌发酵液, 对照组在孔中注入无菌水, 试验组设置3个重复, 置于32 ℃恒温培养箱培养2~4 d后观察并测量抑菌圈直径。发酵产物抑菌活性测定参考文献[22]。
1.2.3 菌种鉴定
生理生化鉴定:筛选的内生菌菌株进行革兰氏染色、甲基红测定、V-P 测定、淀粉水解、吲哚产生和柠檬酸利用检测试验, 试验测定方法及初步鉴定方法参考《常见细菌系统鉴定手册》[23]。
16S rRNA鉴定:采用菌落PCR[24]方法扩增菌株C-22-1的16S rDNA, 采用基因保守序列通用引物, P1(5’ -CGGGATCCAGAGTTTGATCCTGGCTCAGAACGAACGCT-3’ )和P6 (5’ -CGGGATCCTACGGCTACCTTGTTACGACTTCACCCC-3’ )进行 PCR扩增, 50 μ L 反应体系:2× Es Taq Masterase 25 μ L, 上下游引物各 1 μ L(10 μ mol· L-1), 模板DNA 1 μ L, 无菌双蒸水补足至反应总体积50 μ L。反应条件:94 ℃预变性2 min; 94 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸30 s, 30个循环; 72 ℃终延伸7 min; 4 ℃保存。获得的 16S r RNA 基因序列提交到NCBI的GenBank基因库, 进行BLAST比对, 与数据库中的已知序列进行同源性分析, 运用MEGA 6.06软件生成NJ进化树。
1.2.4 代谢产物的分离提取
将菌株C-22-1扩大培养, 无菌条件下, 取直径1 mm的内生菌菌饼4~5个, 接种于含200 mL的发酵液培养基中, 接种25瓶, 置于32 ° C、160 r· min-1摇床中振荡培养7 d。将发酵液离心去菌体, 收集并浓缩菌液, 将5 L的发酵液浓缩至300 mL。浓缩后的发酵液与70%乙醇按体积比1:9混合后浸泡2 h, 40 ° C超声处理10 min, 收集液体, 浓缩, 用正丁醇进行萃取, 浓缩, 再用正丁醇反复萃取2次, 收集液体并用砂芯过滤装置过滤, 最后进行浓缩并收集。
1.2.5 C-22-1发酵产物的定性试验
在研究C-22-1菌株所产皂苷的生物活性之前, 首先通过皂苷的通性进行定性试验, 确定C-22-1菌株发酵产物的总皂苷中含有皂苷类物质, 从而对其进行下一步研究。泡沫试验、浓硫酸-乙酸反应、氯仿-浓硫酸反应、香草醛-高氯酸反应参考邵青[25]的方法进行定性试验。
HPLC检测:甲醇分别溶解标准品、样品于容量瓶中备用。
皂苷检测:色谱柱为Kromasil C18(5 μ m, 4.6 mm× 150 mm); 流动相:V(甲醇):V(0.2%磷酸)=50:50; 流速0.8 mL· min-1; 检测波长210 nm; 柱温25 ° C; 进样量10 μ L。
1.2.6 菌株发酵条件优化
单因素试验:菌株C-22-1分别接种于以葡萄糖、甘露醇、蔗糖、麦芽糖、淀粉为碳源的液体培养基和以蛋白胨、酵母膏、硝酸钠、硫酸铵、硝酸铵为氮源的液体培养基中, 在32 ° C, 恒温振荡培养器中以160 r· min-1的转速培养4 d后取出备用。以金黄色葡萄球菌(Staphylococcus aureus)为指示菌, 参照1.2.2节的方法进行抑菌活性测定, 设置3重复。选出最佳碳源、氮源的培养基为发酵培养基, 发酵时间按5、6、7、8、9 d, 参照1.2.2节进行试验。
响应面试验设计:为了优化发酵条件, 在单因素试验的基础上, 采用Design-Expert试验设计软件对菌株C-22-1的发酵条件进行优化, 以对金黄色葡萄球菌的抑菌圈大小为响应值(Y), 对碳、氮源和发酵时间3个因素设计3因素3水平的Box-Behnken中心组合试验因素与水平(表2)。
| 表2 响应面设计表 Table 2 Response surface design |
采用组织分离法和研磨涂布法从酸枣叶片组织中共分离得到23株内生菌, 编号为C-01-1至C-23-1, C-22-1的发酵液的抑菌效果好, 对7种人体常见致病菌均有抑制作用, 除对白色念球菌(Monilia albican)的抑菌圈直径为12 mm外, 对其他病原菌的抑菌圈直径均大于16 mm, 抑菌活性强, 所以选择其作进一步研究。
对所分离的内生菌的抑菌活性进行初步筛选, 其中菌株C-22-1对7种人体常见致病菌的抑制效果均较好(表3), 因此选择其进行后续试验。同时发酵产物对人体常见致病菌的抑菌活性测定结果(图1)显示, 4号致病菌(福氏痢疾杆菌Shigella flexneri)的最低抑制浓度最小, 对其抑制效果最好。
| 表3 C-22-1对7种致病菌的抑制直径 Table 3 Inhibitory effect of C-22-1 on 7 kinds of pathogenic bacteria in diameter |
菌株C-22-1的菌落特征是表面粗糙, 扁平, 菌落不规则, 菌株C-22-1的细胞呈直杆状, 菌落圆形, 乳白色, 边缘整齐, 光滑; 菌株C-22-1的V.P、柠檬酸盐反应均为阴性, 产生吲哚、能水解淀粉, 甲基红试验显阳性。菌株C-22-1的16S rDNA序列(GenBank登录号KY393358)与NCBI数据库进行比对分析, 与其同源性较高的菌株均属于芽孢杆菌属, 通过构建的系统发育树聚类分析可以看出, 菌株C-22-1与Bacillus gaemokensis KCTC 13318 (登录号LTAQ01000012)属于同一分支即它们有可能为同一类群(图2)。综合形态、结构、生理生化特征和同源性分析, 菌株C-22-1为蜡状芽孢杆菌。
(1)泡沫试验:样品产生了肥皂样泡沫, 且15 min后泡沫仍未消失, 空白对照处理虽然也出现泡沫, 但量极少且在30 s内消失, 此结果也可以初步说明C-22-1粗皂苷样品中可能含有皂苷。
(2)浓硫酸-乙酸反应:试管内显示红色, 并未出现污绿色, 说明样品中含有三萜皂苷。
(3)氯仿-浓硫酸反应:试验结果显示溶液出现分层, 在氯仿层颜色为浅红色, 硫酸层出现绿色的荧光。空白对照试验则无此色泽变化。
(4)香草醛-高氯酸反应:试管溶液最终显示红色。香草醛-高氯酸反应是皂苷类物质的显色方法, 高氯酸的酸性极强, 可与皂苷发生氧化反应使其脱氢, 再与香草醛作用继而形成特征性的红色。
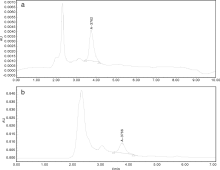
(5)HPLC检测:由图3-a-可以发现, 标准品的出峰时间大约在3.762 min, 受样品中杂质等干扰的影响, 两个图谱存在一定的差别, 但两图谱就总体对比而言, C-22-1正丁醇部位的样品的出峰时间和柴胡皂苷A标准品的出峰时间大致相同(图3-b), 因此可以初步判定C-22-1正丁醇部位提取的样品中含有皂苷类物质。
由图4-a可知, 菌株C-22-1以葡萄糖为碳源时抑菌圈最大, 故最优碳源选为葡萄糖; 由图4-b可以看出, 菌株C-22-1以酵母膏为氮源时抑菌圈最大, 因此最佳氮源为酵母膏; 由图4-c可知, 菌株C-22-1在发酵前8 d抑菌圈也呈上升趋势, 第9天开始下降, 因此最佳发酵时间为8 d。
 | 图4 不同碳源、氮源、时间对菌株C-22-1抑菌活性的影响Fig.4 Effect of different carbon source, nitrogen source and time on antibacterial activity of strain C-22-1 |
回归模型P< 0.01表明, 回归模型极显著; 失拟项P=0.392, 不显著, 说明该模型成立, 回归模型中一次项A、二次项A2、B2、C2以及AC的交互作用对金黄色葡萄球菌的抑菌圈的影响极显著(P< 0.01)。
响应曲面能直观地反映出各因素交互作用对响应值的影响, 交互作用不显著时, 表现为曲线较为平滑, 近似圆形, 交互作用极显著时表现为曲线较陡, 接近椭圆形。由图5可以看出, A和B、C和D的交互作用不显著, A和C的交互作用显著, 与表4结果基本一致。
| 表4 回归模型方差分析 Table 4 Regression model variance analysis |
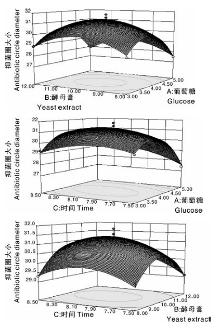 | 图5 葡萄糖、酵母膏和发酵时间对金黄色葡萄球菌的抑菌圈的响应曲面Fig.5 Response surface of glucose, yeast extract and fermentation time |
利用Design-Expert 8.06软件得出菌株C-22-1的最佳发酵条件为葡萄糖4.28 g· L-1, 酵母膏10.12 g· L-1, 发酵时间8.01 d, 考虑到实际操作, 将最佳发酵条件设定为葡萄糖4.30 g· L-1, 酵母膏10 g· L-1, 发酵时间8 d。
| 表5 方差分析其他参考项 Table 5 Other variance analysis references |
从菌株C-22-1发酵液及活性物质抑菌试验结果显示其对人体一些常见致病菌的抑制效果很明显, 可以为药物制备提供种质资源。有研究者从酸枣植株中分离提取出黄酮类、皂苷类化合物[26], 菌株C-22-1可以产生皂苷类化合物, 这可能与内生菌与宿主植物长期共生的协同演化有关。尽管初步鉴定了两株菌代谢产物均含有黄酮、皂苷类化合物, 但还需要进一步对其代谢产物分离纯化。从HPLC图中可看出样品中杂质较多, 纯度低, 需要借助紫外光谱、质谱、红外光谱、核磁共振等技术手段进行结构分析。
植物内生菌可在离体培养的条件下, 采用发酵获得大量活性物质[27], 从而解决某些药用植物资源紧缺、生长缓慢和生态破坏等问题。本试验发现, 酸枣内生菌可合成多种活性物质, 具有广谱的抗菌作用。本试验采用组织分离法和研磨涂布法从陕北酸枣叶片中筛选内生菌共23株, 包括20株内生细菌, 内生细菌占总数的86.96%, 初步证实酸枣叶片中内生菌种类丰富。经测定得到10株有抑菌活性的菌株, 占分离总数的43.48%。其中菌株C-22-1对七种病原菌以及与几种常用抗生素相比, C-22-1发酵液均具有较强的抑菌效果, 所以选其进行更多的研究。本试验还对菌株C-22-1发酵的主要影响因素碳源、氮源以及发酵时间进行单因素优化分析, 明确碳源、氮源和时间对菌株抑菌活性的影响, 以及得出最佳发酵条件。
从酸枣叶片中筛选出的菌株C-22-1的生理生化反应以及16S rRNA的结果与Jung等[28]从潮滩沉积物中筛出来的菌株BL3-6的结果一致, 结果显示, 该菌株为蜡状芽孢杆菌, 可以降解石油。
(责任编辑 张 韵)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|