作者简介:徐爽(1990—),女,陕西咸阳人,硕士研究生,研究方向为植物病原真菌学。E-mail:412728386@qq.com
G蛋白信号调控因子(regulators of G-protein signaling,RGS)是G蛋白的一类负调控因子,在植物病原真菌生长发育及致病过程中起着重要的作用,然而目前还未有关于胶孢炭疽菌( Colletotrichum gloeosporioides)RGS蛋白生物学功能的研究。试验利用PCR技术扩增了胶孢炭疽菌的 CgRGS4基因,通过同源重组的方法获得 CgRGS4基因的敲除突变体,通过表型分析初步确定了CgRGS4的生物学功能。结果表明, CgRGS4编码一个1 224个氨基酸的蛋白,包含RGS、PXA和PX功能域,该基因敲除突变体在营养相对贫瘠的条件下生长较野生型缓慢,对高渗透胁迫的耐受性增强,黑色素减少,对H2O2更加敏感,胞外漆酶及过氧化氢酶活性降低以及致病性减弱。由此可见,CgRGS4参与调控胶孢炭疽菌的营养生长、渗透压响应、氧化应激反应和致病性等多个过程。
Regulators of G-protein signaling (RGS) are a kind of negative regulatory factor of G protein, which play an important role in growth development and pathogenicity of plant pathogen. However, there has been no research on biological functions of RGS in Colletotrichum gloeosporioides up to now. The aim of this study was to clone the gene of CgRGS4 and analyze its biological function in C. gloeosporioides. The CgRGS4 was cloned by PCR, and its gene-knockout mutant was obtained by homologous recombination. The biological functions of CgRGS4 were preliminarily determined through phenotypic analysis. The results showed CgRGS4 encoded a 1 224-amino acids protein, containing RGS, PXA and PX function domains. Compared with the wild type, the knockout mutant of CgRGS4 had slow growth on poor medium, enhanced tolerance to osmotic stress, low melanin content, sensitivity to H2O2, decrease in extracellular laccase and catalase activity, decreased pathogenicity. In conclusion, CgRGS4 is involved in regulation of vegetative growth, osmotic pressure response, oxidative stress response and pathogenicity of C. gloeosporioides.
炭疽菌 (Colletotrichum spp.)是世界上常见的一类植物病原真菌, 常引起果实腐烂、植株枯萎、叶片病斑、死苗等症状, 造成重大的经济损失[1]。胶孢炭疽菌(Colletotrichum gloeosporioides)是一种重要的炭疽病菌, 广泛分布于世界热带、亚热带及温带国家和地区, 可以引起多种植物炭疽病, 宿主包括橡胶、芒果、西瓜、香蕉、柱花草、桃等, 严重危害着世界农业生产[2, 3]。胶孢炭疽菌可以侵染植物的果实、叶片和枝干等, 且具有潜伏性侵染的特点, 对于该病菌的防治也较为困难。目前, 国内外对胶孢炭疽菌的研究主要集中在生物学特性、防治药剂筛选等方面, 而关于该菌侵染过程、致病相关基因和致病机制的报道相对较少, 进而也限制了对该病防治技术的更新和改进[4]。
G蛋白信号途径是真核细胞感受及传递外源信号的重要途径之一, 其参与调控真菌的生长发育、生殖、交配、侵染以及致病等相关过程[5, 6]。G蛋白由其偶联的受体蛋白(GPCR)激活, 当信号配体结合到GPCR时, 与Gα 结合的GDP转变为GTP, 异三聚体的构象发生改变, Gα 与Gβ γ 发生解离[7, 8]。作为有活性的信号分子, Gα 和Gβ γ 分别激活下游的靶蛋白, 从而造成一系列的生理变化。激活的G蛋白随后将GTP重新水解为GDP, 使Gα 和Gβ γ 重新聚合形成失活的异三聚体。其中, G蛋白信号调控因子在G蛋白的信号转导过程中起负调节作用, RGS蛋白激活Gα 的GTP酶活性, 促使GTP水解为GDP, 使Gα 重新与Gβ γ 聚合, 造成G蛋白失活, 从而迅速关闭G蛋白信号途径[9]。
在植物病原真菌方面, RGS蛋白已经在稻瘟病菌(Magnaporthe oryzae)、轮枝镰孢菌(Fusarium verticillioides)和小麦赤霉病菌(Gibberella zeae)中得到鉴定, 其功能主要集中在调控营养生长、有性生殖、cAMP水平、致病性等方面。然而, 至今还未见关于胶孢炭疽菌RGS蛋白生物学功能的报道。在前期研究中, 我们从胶孢炭疽菌中鉴定了10个潜在的RGS蛋白, 命名为CgRGS1-CgRGS10, 它们都包含RGS功能域。本研究对其中一个RGS蛋白CgRGS4的基因进行了克隆, 利用同源重组的方法获得了该基因的敲除突变体, 通过表型分析初步确定了CgRGS4的生物学功能。
1.1.1 质粒和菌株
pMD18-T为TaKaRa公司产品, 胶孢炭疽菌野生型菌株(WT)和敲除载体pCB1532均由本实验室保存。
1.1.2 试剂盒、工具酶及生化试剂
DNA凝胶回收试剂盒、质粒提取试剂盒、限制性内切酶及 PCR相关试剂均购自TaKaRa公司; 引物合成和测序均由华大基因科技有限公司完成; 其他试剂均为国产分析纯。
1.1.3 培养基
CM培养基:胰化蛋白胨 6 g· L-1, 酵母提取物6 g· L-1, 蔗糖10 g· L-1, 琼脂20 g· L-1; PDA培养基:马铃薯200 g· L-1, 葡萄糖20 g· L-1, 琼脂20 g· L-1; PDB培养基:马铃薯200 g· L-1, 葡萄糖20 g· L-1; Czapek培养基:蔗糖30 g· L-1, NaNO3 3 g· L-1, MgSO4 0.5 g· L-1, KCl 0.5 g· L-1, K2HPO4 1 g· L-1, FeSO4 0.01 g· L-1, 琼脂20 g· L-1; MM培养基:K2HPO4 7 g· L-1, 葡萄糖5 g· L-1, KH2PO4 3 g· L-1, (NH4)2SO4 1 g· L-1, 柠檬酸钠 0.5 g· L-1, MgSO4· 7H2O 0.1 g· L-1, 琼脂20 g· L-1。
1.2.1 CgRGS4基因的克隆及序列分析
胶孢炭疽菌总RNA提取采用TaKaRa MiniBEST Plant RNA Extraction Kit(TaKaRa, 中国), 利用PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit(TaKaRa, 中国)合成cDNA。参照GenBank中C. gloeosporioides Nara gc5的RGS基因(XM_007276578)设计ORF框两端引物CgRGS4FⅠ 和CgRGS4RⅠ , 以胶孢炭疽菌野生菌株的cDNA为模板进行扩增, 连接pMD18-T载体后进行测序。利用SMART(http://smart.embl-heidelberg.de/)工具对CgRGS4进行蛋白结构域分析, 通过GenBank中BLASTp工具对CgRGS4进行蛋白同源性分析, 利用MEGA 5.0软件以邻近相接法构建系统进化树。
1.2.2 CgRGS4基因的敲除与转化子筛选
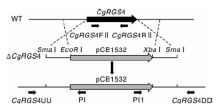
按照图1所示原理构建CgRGS4敲除载体。参照文献[10]的方法提取胶孢炭疽菌基因组DNA, 以基因组DNA为模板, 分别利用CgRGS4上下游片段引物CgRGS4upF/CgRGS4upR和CgRGS4downF/CgRGS4downR(表1)扩增CgRGS4基因的上下游片段。将扩增得到的基因上下游片段依次连接到pCB1532(含氯嘧磺隆抗性基因Sur)上, 酶切验证无误后即获得敲除载体pCB1532-CgRGS4。将pCB1532-CgRGS4通过SmaⅠ 酶切进行线性化, 转化到胶孢炭疽菌野生型菌株的原生质体中, 原生质体制备及转化的方法步骤参照文献[11], 转化子在含有氯嘧磺隆抗性平板中进行筛选, 提取抗性转化子的基因组进行多重PCR验证。根据CgRGS4上游片段的上翼序列和下游片段的下翼序列分别设计引物CgRGS4UU和CgRGS4DD, 并根据pCB1532上靠近上下游片段的序列设计引物PI和PI1(表1), 利用3对引物(CgRGS4FⅡ / CgRGS4RⅡ 、CgRGS4UU/PI和PI1/ CgRGS4DD)对转化子进行PCR鉴定, 引物CgRGS4FⅡ / CgRGS4RⅡ 无扩增条带, 而引物CgRGS4UU/PI和PI1/ CgRGS4DD可以扩出目的片段的转化子为候选的基因敲除突变体(图1)。
| 表1 引物序列 Table 1 Sequences of the primers |
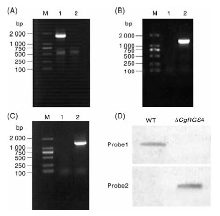
对上述候选敲除突变体进一步进行Southern blot分析:分别提取野生型菌株和候选敲除突变体的基因组DNA, 经限制性内切酶BamHⅠ 酶切后进行凝胶电泳, 以引物CgRGS4FⅡ / CgRGS4RⅡ (表1)的PCR扩增产物(CgRGS4 ORF框的部分序列)作为CgRGS4基因探针(Probe 1), 以引物Sur-F/Sur-R(表1)的PCR扩增产物(pCB1532上Sur基因的部分序列)作为Sur基因探针(Probe 2), 分别进行Southern blot分析。Southern blot操作过程参照罗氏地高辛标记及检测试剂盒操作手册(Roche Applied Science, Penzberg, Germany)。
1.2.3 突变株表型分析
(1)营养生长
胶孢炭疽菌野生型菌株和突变体于PDA培养基上活化7 d后, 取直径5 mm的菌饼分别接种于MM、PDA、CM和Czapek固体培养基上, 28 ℃培养7 d, 测量菌落直径并拍照, 试验设3个重复。
(2)渗透压胁迫因子耐受性
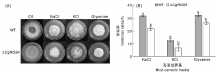
野生型和突变体菌株于PDA培养基上活化7 d后, 取直径5 mm的菌饼分别接种在含0.5 mol· L-1 NaCl, 0.5 mol· L-1 KCl, 1 mol· L-1 丙三醇的MM培养基上, 以接种MM培养基的菌株为对照, 28 ℃培养9 d, 测量菌落直径拍照并计算抑制率, 试验设3个重复。抑制率=(对照组菌落直径-试验组菌落直径)× 对照组菌落直径-1× 100%。
(3)黑色素分泌及胞外漆酶活性测定
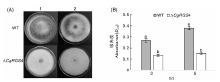
将野生型和突变体菌株接种到PDA培养基上, 28 ℃培养10 d, 观察黑色素分泌情况; 将野生型和突变体菌株以相同接种量接种PDB培养基, 28 ℃振荡培养, 分别于3 d和5 d取菌液, 过滤去除菌丝。将400 μ L菌液加入到1.6 mL含10 mmol· L-1 ABTS的50 mmol· L-1醋酸缓冲液中, 25 ℃反应5 min, 测量D420[12]。
(4)氧化应激性试验
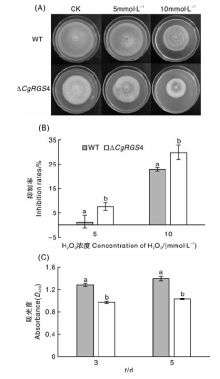
将野生型和突变体菌株接种到含不同浓度H2O2(0.5和10 mmol· L-1)的MM培养基中, 28 ℃培养9 d, 测量菌落直径拍照并计算抑制率; 按照1.2.3节(3)中测定胞外漆酶的方法制备菌液, 将400 μ L菌液加入到1.6 mL含有10 mmol· L-1 ABTS和3 mmol· L-1 H2O2的50 mmol· L-1醋酸缓冲液中, 25 ℃反应5 min, 测量D420[12]。
(5) 致病性测定
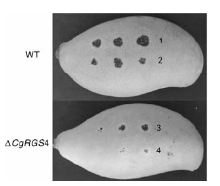
选取无病斑、表面均匀光滑的芒果, 用已灭菌的大头针在芒果表面形成伤口, 于活化7 d的PDA平板上取5 mm菌饼, 分别以无伤口及有伤口的方式接种芒果, 每处理3个重复, 28 ℃保湿培养, 5 d后观察发病情况。
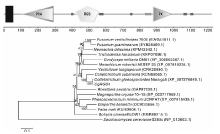
通过PCR扩增获得了CgRGS4基因的cDNA序列, 测序发现CgRGS4基因ORF框全长3 675 bp(GenBank登录号:KX394624), 编码1 224个氨基酸。蛋白结构域分析发现CgRGS4包括3个结构域(PXA、RGS和PX)以及2个跨膜区域(图2-A)。从GenBank下载CgRGS4的同源蛋白序列, 利用 MEGA5.0构建系统进化树(图2-B), CgRGS4与C. gloeosporioides Nara gc5的intermediate filament protein(XP_007276640.1)相似度达到99%, 此外CgRGS4与Colletotrichum sublineola、Verticillium longisporum、Trichoderma harzianum、Neonectria ditissima、Fusarium graminearum等相关蛋白的同源性也较高, 相似度在70%以上。
利用同源重组的方法, 将CgRGS4基因的上游1 000 bp和下游1 081 bp的DNA片段连接到pCB1532载体上构建敲除载体, 敲除载体线性化后转入胶孢炭疽菌野生型原生质体中, 共获得96个转化子, 提取各转化子基因组并进行PCR验证, 其中47号转化子使用CgRGS4FⅡ + CgRGS4RⅡ 引物不能扩增目的条带, 而使用引物CgRGS4UU+PI和PI1+CgRGS4DD能够分别扩增出目的条带(图3-A、B、C)。利用Southern blot对47号转化子做进一步验证, 以CgRGS4基因探针(Probe 1)进行杂交时, 野生型菌株中能检测到单一条带, 而转化子中检测不到条带; 而以Sur基因探针(Probe 2)进行杂交时, 野生型菌株中检测不到条带, 转化子能检测到单一条带, 表明CgRGS4基因已经在47号转化子中成功敲除, 且是单拷贝插入(图3-D)。因此, 确定47号转化子为敲除突变体, 命名为△ CgRGS4。
2.3.1 营养生长
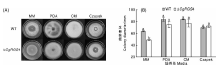
将野生型菌株和△ CgRGS4分别接种于MM、PDA、CM和Czapek培养基中, 28 ℃培养7 d, 结果见图4。与野生型相比, △ CgRGS4在PDA、CM和Czapek培养基上生长没有显著差异。但在营养相对贫瘠的MM培养基中, △ CgRGS4的生长速率显著降低。由此可见, 在营养较贫瘠条件下CgRGS4参与调控菌株的营养生长。
2.3.2 渗透压胁迫因子耐受性
将菌株接种于含有0.5 mol· L-1 NaCl, 0.5 mol· L-1 KCl, 1 mol· L-1丙三醇的MM培养基中, 28 ℃培养9 d, 菌落生长情况如图5-A。与CK相比, 野生型菌株和△ CgRGS4在3种高渗培养基上的生长均受到不同程度的抑制, 计算抑制率发现野生型菌株的生长抑制率均显著高于△ CgRGS4(图5-B), 说明△ CgRGS4与野生型相比对高渗环境具有更高的耐受性。
2.3.3 黑色素产量及胞外漆酶活性测定
将野生型菌株和△ CgRGS4接种于PDA培养基中, 28 ℃培养10 d, 结果发现, 对比△ CgRGS4, 野生菌的菌落颜色明显变黑, △ CgRGS4的黑色素产量明显低于野生型菌株(图6-A)。鉴于漆酶在黑色素产生过程中的重要作用, 进而对△ CgRGS4的胞外漆酶活性进行了测定, 结果显示, △ CgRGS4的胞外漆酶活性显著低于野生型菌株(图6-B)。由此可见, CgRGS4参与调控黑色素及胞外漆酶的产生。
2.3.4 氧化应激反应
将菌株接种于含不同浓度H2O2的MM培养基中, 28 ℃培养9 d。随着H2O2浓度的提高, △ CgRGS4和野生型菌株均受到不同程度的抑制, 且相较于野生型, △ CgRGS4对H2O2更加敏感(图7-A)。抑制率统计发现, △ CgRGS4的抑制率均显著高于野生型(图7-B), 说明△ CgRGS4对H2O2的耐受性降低。进而测定了野生型和△ CgRGS4胞外过氧化氢酶活性, 结果表明, △ CgRGS4的胞外过氧化氢酶活性显著低于野生型菌株(图7-C)。由此可见, CgRGS4参与调控该病菌的氧化应激反应。
2.3.5 致病性测定
将野生型菌株和△ CgRGS4接种到离体芒果上, 培养数天后观察致病效果。结果发现, 无论是伤口接种还是无伤口接种, △ CgRGS4侵染造成的病斑均明显小于野生型菌株(图8), △ CgRGS4的致病性明显减弱。说明CgRGS4对胶胞炭疽菌的致病力造成了一定影响。
RGS蛋白是G蛋白信号途径中一类重要的调控因子, 生物体内常含有多个RGS蛋白, 从事不同的调控功能。酿酒酵母含有4个RGS蛋白(Sst2、Rgs2、Rax1和Mdm1), 在有性生殖、维持细胞极性和在高温下维持细胞遗传方面起着不同的作用[13, 14, 15]; 稻瘟病菌含有8个RGS蛋白(MoRGS1-MoRGS8), 参与调控该病菌营养生长、细胞壁完整性、有性/无性产孢、附着胞分化和侵染菌丝的生长等生理过程[16]; 在轮枝镰孢菌中, 6 个RGS蛋白(RgsA、RgsB、RgsC1、RgsC2、FlbA1和FlbA2)得到鉴定, 分别参与调控分生孢子形成和伏马菌素B1的合成, 对宿主乙烯的合成也产生了一定影响[17]; 在小麦赤霉病菌中, 7个RGS蛋白(FgFlbA、FgFlbB、FgRgsA、FgRgsB、FgRgsB2、FgRgsC和FgGprK)在营养生长、分生孢子形成、毒素产生、有性生殖及致病过程中发挥着不同的作用[18]; 可以看出, RGS蛋白在植物病原菌生长发育及致病过程中发挥着重要的作用。
本研究发现, CgRGS4蛋白对胶孢炭疽菌的营养生长、渗透压响应、氧化应激反应、黑色素产量及致病性都具有一定的影响。在稻瘟病菌中, CgRGS4的同源基因MoRGS4在分生孢子、附着胞和侵染菌丝阶段的表达量均有所变化, 表型分析发现MoRGS4对有性生殖, 分生孢子产生、胞内cAMP水平、胞外漆酶和过氧化氢酶的活性以及致病性方面都有影响。此外, CgRGS4的同源基因在酿酒酵母、小麦赤霉病菌和轮枝镰孢菌中也得到了研究。在酿酒酵母中, 同源蛋白ScMdm1是维持高温条件下细胞核遗传和线粒体遗传的必要蛋白, 主要存在于RNA和核糖体合成末期及DNA合成前期的细胞中; 在小麦赤霉病菌中, 同源蛋白FgRgsC影响子囊壳内子囊孢子的产生以及子囊壳的形状; 而在轮枝镰孢菌中, 同源蛋白FvRgsC1并未表现出明显的功能。
通过芒果接种发现, △ CgRGS4的致病性明显降低, 此外试验发现△ CgRGS4胞外漆酶和过氧化氢酶活性也显著降低。在真菌中, 漆酶的活性与色素的形成、子实体的形成、分生孢子的致病性和脱毒作用等有关[19]。一些植物病原真菌还能利用漆酶免受宿主植保素和鞣质等化合物的影响[20]。因此, 漆酶可看成是许多真菌致病的一种毒力因子。在植物与病原菌互作过程中, 植物表面会产生大量的活性氧抵抗病原菌侵入, 同时病原菌为了达到侵染的目的, 会分泌一定量的胞外过氧化氢酶来降解这些植物表面活性氧[21]。研究表明, 在稻瘟病菌中Moswi6基因参与调控了一些胞外过氧化物酶相关基因的表达, 影响到了活性氧解毒的能力, 进而导致稻瘟病菌致病性的改变[22]。鉴于以上研究, 我们推测△ CgRGS4胞外漆酶和过氧化物酶活性降低可能是导致其致病性下降的主要原因, 关于CgRGS4对致病性的具体调控机制还有待更深层次的研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|