作者简介:蒋晗(1987—),女,浙江杭州人,博士研究生,研究方向为食品生物技术。E-mail:jianghan825@126.com
为获得高产双肽细菌素plantaricin JK,通过PCR扩增获得 pln J和 pln K基因,构建表达载体pET32a(+)- pln J-BL21(DE3)和pET32a(+)- pln K-BL21(DE3),经IPTG诱导表达后,利用镍亲和层析柱进行分离纯化,重组蛋白经肠激酶酶切纯化后,细菌素pln J和pln K的产量分别为2~3、5~8 mg·L-1。利用牛津杯平板抑菌法研究抗菌活性,结果显示细菌素pln J和pln K对柠檬色葡萄球菌( Staphylococcus citreus)、大肠埃希菌( Escherichia coli)、藤黄微球菌( Micrococcus luteus)和单核细胞增生李斯特菌( Listeria monocytogenes)都有明显抑制作用,且双肽细菌素plantaricin JK的抑菌圈直径大于单独的细菌素pln J或pln K。
In order to obtain the high-yield two-peptide bacteriocin plantaricin JK, pln J and pln K were successfully heterologously expressed in Escherichia coli BL21 (DE3), and were induced by IPTG. Then the two peptides were expressed as His6-tag fusion proteins and were separated by Ni2+ chelating affinity chromatography. The fusion proteins were cleaved by enterokinase and further purified. The yields of pln J and pln K were around 2-3 and 5-8 mg·L-1. The antibacterial activity of the peptides against 4 indicator strains, i.e. Staphylococcus citreus, Escherichia coli, Micrococcus luteus, Listeria monocytogenes, was analyzed by agar diffusion method. It was shown that pln J and pln K both could inhibit the growth of the 4 indicator strains, but plantaricin JK had larger inhibition zone than pln J or pln K alone.
乳酸菌(lactic acid bacteria, LAB)是美国食品与药品监督管理局(FDA)认定的食品级微生物, 乳酸菌及其代谢产物一般被认为是安全的(generally regarded as safe, GRAS)[1]。乳酸菌细菌素作为一种天然的食品防腐剂, 其原始产生菌对细菌素具有自身免疫性, 又因为其本质为蛋白质或多肽, 所以能够被胃肠道内的蛋白酶降解, 具有高效、无毒、无残留、无抗药性、耐酸、耐高温等特点, 受到各国科学家的关注[2, 3]。目前, 已在乳球菌、片球菌、双歧杆菌、肠球菌、明串珠菌、链球菌、肉食杆菌、乳杆菌等8属的乳酸菌中发现40多种乳酸菌细菌素[4]。
笔者所在实验室团队从健康婴儿粪便中筛选到1株具有良好抑菌活性的新型植物乳杆菌(Lactobacillμ s plantarum) ZJ316, 经全基因组测序, 发现其基因簇中含有编码二肽细菌素plantaricin JK的基因pln J和pln K[5]。天然plantaricin JK的分离纯化方法复杂, 表达困难且产量很低, 不利于大规模生产和后续深入研究, 化学合成细菌素效率高, 可用作深入研究, 但成本太高不利于市场应用; 而异源表达在提高细菌素产量上提供了新的可能。在所有的表达宿主中, 大肠埃希菌(Escherichia coli)被认为是遗传背景最清楚、表达系统最成熟完善的基因工程菌。Plantaricin JK属于Class Ⅱ b类细菌素, 少有翻译后修饰, 是基因工程技术的主要研究对象。本研究拟以细菌素pln J和pln K为研究对象, 通过基因工程手段将其在E. coli BL21 (DE3)中表达, 形成带His标签的融合蛋白, 经镍柱纯化和肠激酶酶切分离纯化后, 再采用RT-HPLC纯化, 获得高产高纯并有抑菌活性的双肽细菌素plantaricin JK, 为其作为生物防腐剂投入市场提供可能。
1.1.1 菌株与载体
宿主菌E. coli DH5α 购自宝生物工程(大连)有限公司, E. coli BL21 (DE3)购自New England Biolabs (NEB, USA)公司。克隆载体pUC57和表达载体pET 32a(+)购自美国Novagen公司。抗菌活性检测菌株藤黄微球菌(Micrococcus luteus), 柠檬色葡萄球菌(Staphylococcus citreus), 单核细胞增生李斯特菌(Listeria monocytogenes)和大肠埃希菌(E. coli)均为本实验室保存。
1.1.2 主要仪器
蛋白质快速纯化系统AKTA purifier 100, GE; 蛋白质垂直电泳系统, Bio-Rad; 台式高速冷冻离心机3K30, Sigma; 恒温振荡器 DHZ-C-1, 太仓市实验设备厂; 超净台SW-CJ-2FD, 上海博迅; 高压细胞破碎仪AH-1500, 德国力士乐。
1.1.3 主要试剂
DNA电泳和蛋白电泳所需试剂均购自生工生物工程(上海)有限公司。PCR试剂购自Takara公司。SanPrep 柱式质粒DNA小量抽提试剂盒、SanPrep柱式PCR产物纯化试剂盒、SanPrep柱式DNA胶回收试剂盒均购自生工生物工程(上海)有限公司。肠激酶购自英国New England Biolabs (NEB)公司。引物由生工生物工程(上海)有限公司合成。
1.2.1 基因片段设计与合成
基因片段pln J和pln K的序列来自于实验室分离的植物乳杆菌ZJ316, 去除前导序列, 添加1个肠激酶位点(用斜体表示)(5’ -GATGATGATGATAAA-3’ )和2个限制性内切酶位点(用下划线表示)— — Kpn Ⅰ (-GGTACC-), Nco Ⅰ (-CCATGG-), 两端最后加入保护碱基, 并由生工生物工程(上海)有限公司合成。完整序列如下。
pln J: CGGGGTACCGATGATGATGATAAAGG-
CGCTTGGAAAAATTTCTGGTCTAGTTTAAGAAAA-
GGATTTTATGATGGCGAAGCTGGCAGAGCAATC-
CGTCGTTAACCATGGCATG;
pln K: CGGGGTACCGATGATGATGATAAACG-
TCGGAGTCGTAAAAATGGAATTGGATACGCTAT-
TGGTTATGCGTTTGGCGCGGTTGAACGGGCCGT-
GCTTGGTGGTTCAAGGGATTATAATAAGTGACC-
ATGGCATG。
1.2.2 引物设计及 PCR扩增
根据合成的碱基序列设计相应引物。Kpn Ⅰ 和 NcoⅠ 酶切位点用下划线表示。pln J的引物:P1, 5’ -CGGGGTACCGATGATGATGATAAAGGC-3’ ; P2, 5’ -CATGCCATGGTTAACGACGGATTG-3’ 。pln K的引物:P3, 5’ -CGGGGTACCGATGATGATGATAAAC-3’ ; P4, 5’ -CATGCCATGGT CACTTATTATAATCCC-3’ 。PCR扩增体系(50 μ L): PrimeSTAR HS DNApolymerase 0.5 μ L, 5× PS buffer (Mg2+ plus) 10 μ L, dNTPs (10 mmol· L-1) 4 μ L, 上下游引物(10 μ mol· L-1)各1.5 μ L, 模板DNA 1.5 μ L。扩增程序:94 ℃预变性5 min; 94 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸30 s, 35个循环; 72 ℃延伸10 min。产物经琼脂糖凝胶电泳检测分子量和纯度。
1.2.3 原核表达载体构建
PCR 产物与pET 32a(+)质粒分别进行Kpn Ⅰ 和 Nco Ⅰ 双酶切, 酶切产物纯化回收, 经T4-DNA连接酶16 ℃过夜连接, 转化至E. coli DH5α 感受态细胞, 涂布于氨苄抗性琼脂平板, 37 ℃过夜培养, 选择阳性克隆菌株转化至表达菌株E. coli BL21 (DE3), 再次涂布于氨苄抗性琼脂平板, 37 ℃过夜培养, 选择阳性克隆菌株进行菌落PCR鉴定, 提取质粒进行Kpn Ⅰ 和 Nco Ⅰ 双酶切鉴定, 后将阳性克隆送至生工生物工程(上海)有限公司测序。
1.2.4 融合蛋白表达
重组菌株pET32a(+)-pln J-BL21(DE3)和pET32a(+)-pln K-BL21(DE3)分别以1%的接种量接种至50 mL LB液体培养基(含氨苄)中, 200 r· min-1, 37 ℃过夜培养。将新鲜菌液以1%的接种量转接至2 L的LB液体培养基(含氨苄)中, 200 r· min-1, 37 ℃培养至菌液D600达到0.6~0.8时, 向培养基中添加异丙基-β -D-硫代吡喃半乳糖苷(isopropyl β -D- thiogalactoside, IPTG), 终浓度为1 mmol· L-1, 140 r· min-1, 18 ℃摇床诱导16 h。将过夜诱导的菌液8 000 r· min-1离心10 min, 收集菌体沉淀, -20 ℃备用。将收集的菌体沉淀用少量PBS缓冲液(pH为7.4)洗涤, 4 ℃, 8 000 r· min-1离心10 min, 收集菌体沉淀, 然后按照每100 mL培养基所得菌体10 mL缓冲液的比例加入预冷的PBS缓冲液重悬细胞。菌体悬液通过超高压破碎系统进行细胞破碎, 800 MPa重复破碎3次, 此时菌悬液基本澄清。以4 ℃、10 000 r· min-1、20 min的条件对菌悬液进行离心。此时可溶性表达的蛋白存在于上清中。收集上清, 经SDS-PAGE鉴定后用于后期的亲和纯化。
1.2.5 融合蛋白亲和纯化
利用5 mL HisTrap HP预装柱和AKTA Purifier蛋白纯化仪进行蛋白纯化。所有样品液采用0.22 μ m一次性针头式过滤器过滤。结合缓冲液包含20 mmol· L-1 Tris, 300 mmol· L-1氯化钠, 10 mmol· L-1咪唑, 用HCl调节pH至8.0; 洗脱缓冲液包含20 mmol· L-1 Tris, 300 mmol· L-1氯化钠, 500 mmol· L-1咪唑, 用HCl调节pH至8.0。HisTrap预装镍柱以10倍柱体积的超纯水和结合缓冲液清洗后, 洗脱缓冲液以10%~100%的梯度, 流速0.5 mL· min-1洗脱目标蛋白, 每5 mL收集1管。洗脱缓冲液100%洗脱完后, 继续跑3~5个柱体积。之后采用100%结合缓冲液、超纯水冲洗管路, 最后以20%乙醇冲洗管路, 保存HisTrap HP预装柱。收集与洗脱峰对应的收集管溶液, 进行SDS-PAGE检验, 将目标蛋白于-4 ℃冷藏暂存。
1.2.6 融合蛋白肠激酶酶切
利用BCA蛋白浓度测定试剂盒测定重组蛋白浓度。利用肠激酶对重组蛋白进行酶切, 13 ℃过夜酶切 16 h。采用规格为15 mL、滤膜孔径大小为10 ku的超滤离心管对酶切产物进行初步分离, 离心条件为4 ℃, 4 800 g, 60 min。离心后下层滤液中含有目标细菌素片段。
1.2.7 pln J和pln K抑菌活性测定
将冷冻干燥得到的细菌素pln J和pln K以0.05%乙酸溶解, 终浓度为20 μ mol· L-1。利用琼脂扩散实验[6]研究单独的pln J或pln K及plantaricin JK的抗菌效果, 指示菌分别为柠檬色葡萄球菌、大肠埃希菌、藤黄微球菌和单核细胞增生李斯特菌。
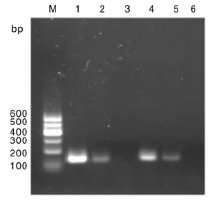
pln J和pln K的基因PCR扩增结果如图1所示, 扩增片段大小均在100~200 bp之间, 与理论值基本相符, 阴性对照则没有出现特异性片段。
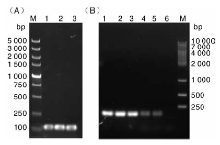
重组质粒转化表达菌株E.coli BL21(DE3)后, 在氨苄抗性平板上筛选出阳性转化子。转化子在含有氨苄的LB培养基培养后, 取适量菌液作模板, 进行菌液PCR验证, PCR产物片段大小与理论值基本相符(图2)。将阳性转化子测序, 测序结果与目标基因序列一致。
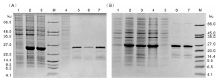
对重组菌株pET32a(+)-pln J-BL21(DE3)和pET32a(+)-pln K-BL21(DE3)进行IPTG诱导表达及镍柱亲和纯化, 并做SDS-PAGE鉴定。如图3所示, 与未诱导的重组菌株相比, 诱导后重组菌株表达出目的蛋白条带。理论上, Trx-His6-pln J和Trx-His6-pln K的大小分别为22.7和23.5 ku, 图3中的目的蛋白条带均与理论值相符。经镍柱亲和纯化后的融合蛋白与未纯化时相比, 条带较为单一, 杂质已基本去除。
利用BCA蛋白浓度测定试剂盒及标准曲线计算出浓缩后的重组蛋白Trx-His6-pln J和Trx-His6-pln K的浓度分别为2.46和3.17 mg· mL-1。按说明书要求计算, 1 mL Trx-His6-pln J需用肠激酶7.88 μ L, 1 mL Trx-His6-pln K需用肠激酶10.14 μ L。
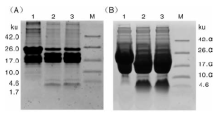
图4是Trx-His6-pln J和Trx-His6-pln K酶切的Tricine-SDS-PAGE鉴定结果, 在4 ku附近均有条带, 与pln J和pln K的理论大小4.6和3.5 ku相符。但pln J的条带颜色较浅, 表明经镍柱亲和纯化和肠激酶切割融合标签后, 损失较大。
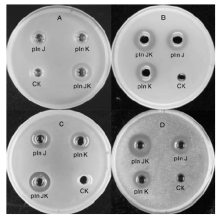
以实验室保存的4株菌为指示菌, 用终浓度为20 μ mol· L-1的pln J、pln K和以pln J、pln K等摩尔混合的plantaricin JK进行琼脂扩散实验, 以0.05%乙酸为阴性对照(CK), 检测并比较其抑菌活性。抑菌圈的评价标准是直径和透明度, 越大越透明说明抑菌效果越好。结果如图5所示:阴性对照对各指标菌均无抑菌活性; 单独的细菌素pln J或pln K对大肠埃希菌均有一定的抑菌效果, 两者混合得到的双肽细菌素plantaricin JK条件下, 抑菌圈变大, 说明抑菌效果增强(图5-A); 单独的细菌素pln J或pln K对单核细胞增生李斯特菌均有一定的抑菌效果, 两者混合得到的双肽细菌素plantaricin JK条件下, 抑菌圈略变大, 圈变得更透明, 说明抑菌效果增强(图5-B); 在柠檬色葡萄球菌(图5-C)和藤黄微球菌(图5-D)上的试验结果与在大肠埃希菌、单核细胞增生李斯特菌上相似。由此推断, 异源表达的pln J 和pln K仍能保持较好的抑菌活性, 且等摩尔比混合后, 存在一定的协同作用。
乳酸菌细菌素在食品防腐保鲜、饲料和医疗中的应用研究均有报道[7, 8, 9], 其中Nisin更是成为FDA认证的已大量投入商业使用的乳酸菌细菌素[10]。通过传统分离纯化手段获得细菌素的得率很低, 化学合成细菌素工业化生产成本较高。基因工程技术近几年的飞速发展使这个问题有望解决。Pediocin PA-1是最常被用于异源表达的乳酸菌细菌素, Beaulieu等[11]利用大肠埃希菌基因工程菌和Thioredoxin(Trx)标签以及肠激酶酶切位点, 最终得到有活性的纯化蛋白, 含量达到10 mg· L-1。亦有研究利用大肠埃希菌构建基因工程菌进行异源表达, 得到能够抑制耐甲氧西林金黄色葡萄球菌的Plantaricin Pln1, 得率为9~11 mg· L-1[12]。二肽细菌素Plantaricin EF通过异源表达, 得率在1~1.5 mg· L-1[13]。Plantaricin JK是Class Ⅱ b类乳酸菌细菌素, 由位于同一个操纵子的2个基因编码的寡肽pln J和pln K组成, 可利用2条寡肽的协同作用抑制多种细菌, 是潜在的天然食品防腐剂和抗生素替代品[14]。本研究通过基因工程手段成功在E. coli BL21 (DE3) 中实现pln J和pln K的异源表达, 形成带His标签的可溶性融合蛋白, 经镍柱纯化和肠激酶酶切纯化后, pln J的产量为每升培养基2~3 mg, pln K的产量为每升培养基5~8 mg。经抗菌活性实验可知, 异源表达的plantaricin JK也有很好的抑菌活性, 且pln J与pln K存在一定的协同作用。若能在今后的研究中进一步优化分离纯化方法, 将有良好的市场应用前景。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|