作者简介:王寒(1991—),女,湖南永州人,硕士研究生,研究方向为动物临床分子诊断与治疗。E-mail:791390483@qq.com
为了解四川地区禽源空肠弯曲菌( Campylobacter jejuni)的遗传多样性和毒力相关基因的携带情况,对从四川成都、雅安及眉山市采集的鸡源、鸭源和鹌鹑源的盲肠及肛拭子样品进行 C. jejuni的分离鉴定、ERIC-PCR分型和17种毒力相关基因的检测分析。结果显示,总体分离率为10.23%(48/469),其中鸡源分离率显著高于鹌鹑源( P<0.05)。ERIC-PCR聚类分析显示48株 C. jejuni可分为6簇、16类共31种基因型,不同场分离株多在某一类或某一簇内聚集分布,而部分菌株在不同地区、不同场之间呈交叉分布。毒力基因检测结果显示,15种毒力相关基因的携带率在50%以上,其中鹌鹑源分离株的毒力基因携带率高于其他动物的携带率。由此表明四川地区禽源 C. jejuni毒力基因的携带率高并且具有较高的遗传多样性。
In order to investigate the genetic diversity and virulence related genes of Campylobacter jejuni in some areas of Sichuan, the samples of the cecum and anal swab collected from the chickens, ducks and quails from Chengdu, Ya'an and Meishan were isolated and identified for C. jejuni, and the ERIC-PCR typing and seventeen virulence-related genes were detected and analyzed. The results of isolation showed a 10.23% separation rate (48/469), and the isolation rate from chicken was higher than that from quail( P<0.05). ERIC-PCR cluster analysis showed that forty-eight strains of C. jejuni could be divided into six clusters, and there were sixteen species and thirty-one genotypes. The isolates from each farm were clustered and distributed in some species or cluster, while some isolates showed cross distribution in different regions and different farms. The carrying rate of fifteen virulence related genes was above 50%, and the carrying rate of virulence related genes of quail was higher than other animals. The results suggested that the C. jejuni isolates from poultry of Sichuan area possessed high carrying rate and high genetic diversity.
空肠弯曲菌(Campylobacter jejuni)是一种重要的人兽共患致病菌, 主要引起人的细菌性腹泻, 严重的可引发格林巴利综合征等[1]。禽类是带菌率最高的动物, 有研究发现C. jejuni在肉鸡盲肠的定殖高达109 cfu· g-1, 在其屠宰加工过程中肠内容物以及排泄物极易造成禽类食品的污染, 人类食用被污染的禽类食品是感染C. jejuni的最主要来源[2]。近年来, 人C. jejuni的感染率在世界范围内呈普遍上升趋势, 国外调查发现, 零售鸡肉C. jejuni的污染率在90%~100%, 加强C. jejuni的监测显得尤为必要[3, 4]。禽类肠道C. jejuni的携带情况高低不一, 研究发现肉鸡群C. jejuni的流行率在3%~90%, 这种差异与肉鸡群的地理分布密切相关, 屠宰场阳性鸡群C. jejuni的分离率可以高达80%[5, 6, 7]。因此调查不同地区禽类C. jejuni的携带情况对于防控人C. jejuni感染具有重要意义。
ERIC-PCR(enterrobacterial repetitive intergernic consensus PCR)作为一种有效的分子分型方法, 已经成功运用于多种病原微生物的分子流行病学调查[8, 9, 10]。该技术以肠杆菌科基因间重复序列为引物进行PCR, 能扩增出多态性的DNA图谱, 能够同时平行分析不同属别、种别乃至菌株间的差异, 结合软件的指纹分析技术, 可以动态监测细菌的流行病学相关特征, 同时能够反映出不同菌株的基因型、系统进化和分类学关系[11]。
迄今为止, 人们对C. jejuni感染的发病机制尚未完全了解, 其致病机制包括黏附、趋化、定殖、侵袭、产生毒素以及致病相关的分泌蛋白等, 有研究证实毒力相关基因是其主要的致病因素。翟海华等[12]、薛峰等[13]、郑扬云等[14]分别调查过胶东半岛、华东地区以及华南地区C. jejuni毒力相关基因的携带情况, 但是尚未见四川地区C. jejuni毒力相关基因携带情况的有关调查。本研究对四川部分地区活禽市场及养殖场禽源C. jejuni进行分离鉴定, 以便进一步了解四川地区禽源C. jejuni的分布, 同时运用ERIC-PCR对分离菌株进行分型以及对毒力基因的携带情况进行调查, 为分析菌株的分子流行病学特征及细菌的致病力提供一定的参考依据。
1.1.1 样品
采集四川省成都市(温江、金堂)3家活禽市场和3家养鸡场, 雅安市1家养鸡场和眉山市1家鹌鹑养殖场的鸡、鹌鹑和鸭盲肠及肛拭子样品共计469份。
1.1.2 培养基、试剂、抗生素及引物
脑心浸液肉汤、改良Skirrow氏琼脂基础、改良Skirrow琼脂添加剂、氧化酶试剂、1%马尿酸钠、吲哚醋酸酯纸片均购自青岛高科技工业园海博生物技术有限公司; 哥伦比亚血琼脂基础购自OXOID公司; 脱纤维绵羊血、小牛血清购自北京平睿生物科技有限公司; 其他试剂均为国产分析纯。
细菌基因组提取试剂盒、Taq DNA 聚合酶(5 U· μ L-1)、10× PCR Buffer、dNTPs(2.5 mmol· L-1)、2× Taq PCR Master Mix均购自上海生工生物工程有限公司; DNA Marker 2000、DNA Marker 5000购自宝生物工程(大连)有限公司。
引物:多重PCR鉴定引物参照何蕊等[15], 用于ERIC-PCR分型引物参照Versalovic等[16], 毒力基因检测引物参照翟海华等[12]、薛峰等[13]。以上引物均由北京六合华大基因科技有限公司合成。
样本制成生理盐水混悬液后用接种环直接沾取划线接种在改良Skirrow血平板上, 置于含10%气体环境的二氧化碳培养箱中, 42 ℃培养48 h后, 挑取不溶血、灰色、扁平、湿润、边缘不整齐、沿划线处生长, 或是分散的单菌落呈灰色、凸起、沿线生长的可疑菌落转接到哥伦比亚血平板上纯化培养, 42 ℃微需氧培养48 h后进行进一步鉴定。
1.3.1 多重PCR鉴定
选取弯曲菌属16S rRNA基因、空肠弯曲菌mapA 基因和结肠弯曲菌 ceuE 基因设计引物, 引物序列见表1。PCR反应体系为25 μ L, 其中2× Taq PCR Master Mix 12.5 μ L, 模板DNA 2 μ L, 上、下游引物各0.25 μ L, 灭菌ddH2O补足体系。反应程序:95 ℃预变性5 min; 95 ℃变性30 s, 59 ℃退火90 s, 72 ℃延伸1 min, 35个循环; 最后72 ℃延伸10 min, 在凝胶成像仪上观察结果。
| 表1 弯曲菌PCR扩增基因及引物序列 Table 1 Gene amplification and primer sequences of Campylobacter PCR |
1.3.2 生化鉴定
参照国标GB/T4789— 2014食品空肠弯曲菌的检验方法, 对分离株进行生化鉴定。
取经鉴定过的纯培养菌落按市售用于细菌 DNA 提取试剂盒方法提取细菌的DNA, 置于-20 ℃冰箱中备用。
1.5.1 ERIC-PCR反应条件
上游引物:5'-ATGTAAGCTCCTGGGGATTCAC-3'; 下游引物:5'-AAGTAAGTGACTGGGGTGAGCG-3'。反应体系 25 μ L, 其中含DNA模板1 μ L、10 μ mol· L-1引物各2 μ L、2.5 mmol· L-1 dNTPs 2.5 μ L、25 mmol· L-1 MgCl2 3 μ L、10 × PCR Buffer 2.5 μ L、5 U· μ L-1Taq DNA聚合酶0.3 μ L。反应程序为:94 ℃预变性5 min; 94 ℃变性30 s, 35 ℃退火1 min, 72 ℃延伸4 min, 35个循环; 最后72 ℃延伸10 min, 扩增产物经20 g· L-1琼脂糖凝胶电泳检测。随机挑取14株空肠弯曲菌进行ERIC-PCR扩增, 以验证ERIC-PCR的分型能力。为进一步证实不同时间ERIC-PCR的可重复性, 对随机挑选的空肠弯曲菌在2周后进行重复性试验。
1.5.2 ERIC-PCR指纹图谱分析
以Gel-Pro-Analyzer4.0软件对电泳条带进行处理, 制作二进制数列的矩阵图。数据导入 NTSYS-pc 2.10 软件, 按非加权对数算术平均法(unweighted pair group method using averages algorithm, UPMGA)进行聚类分析, 绘制遗传关系图。每一个分离株看作一个分类学单位(operational taxonomic unit, OTU), 并把相似性大于或等于 90%的菌株看作起源相同的分离株, 即为同一基因型, 并把相似性大于80%的菌株归为一类, 相邻的类处于同一分支的归为一簇[17, 18]。
合成17个毒力相关基因引物:flaA、cheY、cheW、cdtA、cdtC、racR、cadF、iamA、dnaJ、virBⅡ 、grpE、peb1A、cdtB、pldA、neuB1、wlaN和ciaB。引物序列和反应条件见表2, 在凝胶成像仪上观察结果。反应体系为25 μ L, 其中模板DNA 1 μ L, 2× Taq PCR Master Mix 12.5 μ L, 上下游引物(10 μ mol· L-1)各0.5 μ L, 灭菌ddH2O补足体系。
| 表2 毒力相关基因的PCR引物序列及反应程序 Table 2 PCR primer sequence and reaction procedure of virulence related genes |
经细菌培养、多重PCR鉴定以及生化鉴定, 从四川成都、雅安、眉山采集的469份禽盲肠及肛拭子样品中共分离出48株空肠弯曲菌, 总体分离率为10.23%, 具体信息如表3。不同动物来源C. jejuni的分离率在统计学上有显著差异(P< 0.05), 其中鸡源C. jejuni分离率显著高于鹌鹑源(P< 0.05), 鸭源和鹌鹑源、鸭源和鸡源的分离率无显著性差异(P> 0.05)。 由表4可知, 金堂养鸡场的分离率高达22.50%, 除此之外, 来自温江3个活禽市场C. jejuni的分离率均高于15%, 其他场的分离率均在10%以下, 养殖场来源的分离率普遍高于市场来源。
| 表3 不同动物C. jejuni的分离情况 Table 3 Isolation of C. jejuni from different animals |
| 表4 不同场C. jejuni的分离情况及菌株分布 Table 4 Isolation and distribution of C. jejuni in different farms |
2.2.1 ERIC-PCR扩增
对随机挑选的14株C. jejuni分离株的DNA模板进行ERIC-PCR扩增、电泳, 结果表明ERIC-PCR具有较强的分型能力(图1)。为了进一步证实不同时间ERIC-PCR结果的可重复性, 对上述空肠弯曲菌在2周后进行了重复试验, 结果一致。
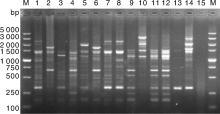 | 图1 十四株C.jejuni ERIC-PCR电泳图M, DNA分子质量标准; 1~14, ERIC-PCR型别; 15, 阴性对照Fig.1 The subtype of ERIC-PCR for fourteen C. jejuni isolatesM, DL5000 DNA Marker; 1-14, ERIC-PCR profiles; 15, negative control |
2.2.2 ERIC-PCR对不同地区及不同场来源空肠弯曲菌分型
运用ERIC-PCR对四川不同地区及不同场来源的48株C. jejuni进行分析, 如图2所示, 共得到31种基因型(E1-E31), 菌株分布最多的基因型为E28, 共包含8株菌, 分别为V9-V16, 其中V9、V10、V11、V15与V16以及 V12、V13与V14的相似性均为100%, 可以看作相同菌株。相似性在80%以上的菌株可以认为是同一来源菌株, 48株菌可分为16类, 相邻的类别处于同一分支的聚为一簇, 48株菌又可分为6簇(Ⅰ -Ⅵ ), 相似性在66%~100%。表5为不同场空肠弯曲菌的类型分布表, 由表5可以看出, 不同场分离株多在某一类或某一簇内聚集分布, 而部分菌株在不同地区、不同场之间呈交叉分布。
| 表5 不同场空肠弯曲菌的类、型分布 Table 5 Classification and type distribution of C. jejuni isolated from diffirent farms |
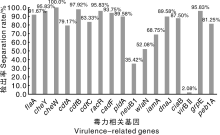
由图3C. jejuni分离株毒力相关基因分析显示, 黏附相关基因flaA、peb1A、cadF的携带率分别为91.67%、81.25%、93.75%; 定殖相关基因cheY、racR的携带率均为95.83%, 侵袭相关基因pldA、iamA、ciaB和cheW的携带率分别为89.58%、68.75%、87.50%和100%; 毒素调节基因cdtA、cdtB、cdtC的携带率分别为79.17%、97.92%、83.33%; C. jejuni 脂多糖外核心寡糖(LOS)合成相关基因wlaN、neuB1的携带率为52.08%和35.42%; 热休克相关蛋白基因grpE、dnaJ的携带率分别为95.83%、89.58%, 质粒基因virBⅡ 的携带率为2.08%。其中同时携带有13种毒力相关基因的菌株有35株, 占总分离数的72.92%, 同时携带有14种毒力相关基因的菌株有27株, 占总分离数的56.25%, 18株含有15种以上的毒力基因, 占总数的37.50%, 7株携带16种以上的毒力基因, 占总数的14.58%。
不同来源菌株的毒力相关基因统计如表6, 鸡源C. jejuni携带所有的毒力相关基因, 只有cheW的携带率为100%; 鹌鹑源携带除毒力质粒基因virBⅡ 之外的所有毒力相关基因, 除cdtC、wlaN和neuB1外, 其他13种毒力相关基因的携带率均为100%; 鸭源不携带cdtC、neuB1、wlaN、iamA和virBⅡ 基因, 除cdtA基因携带率为50%外, 其他毒力相关基因的携带率均为100%。
| 表6 不同动物来源C. jejuni毒力相关基因的携带率 Table 6 The percentage of virulence-related genes in C. jejuni isolates from different animal sources |
C. jejuni能定殖于包括鸡、鸭、鹌鹑在内的多种家禽, 其中肉鸡群C. jejuni的携带率很高。本研究中禽源C. jejuni的总体分离率为10.23%, 其中活禽市场的分离率普遍高于养殖场来源的分离率, 提示动物在运输加工过程中可能存在交叉污染的风险。鸭源的分离率最高, 可能与采集的鸭源样本较少有关, 鸡源的分离率显著高于鹌鹑来源, 说明肉鸡C. jejuni的带菌率高。国内报道的禽类C. jejuni的流行在1.9%~40%[19, 20, 21, 22, 23]; 国外报道肉鸡群C. jejuni的流行在3%~90%。不同研究结果有差异, 推测可能原因是由于不同地区、季节和不同生产类型都会影响禽类C. jejuni分布。
由于受到环境、药物及动物本身等因素的影响, C. jejuni的遗传物质也发生了一定的变化, 产生了新的基因特征。已经测序的空肠弯曲菌的全基因组测序结果表明, 该菌的基因组呈高度的可塑性, 提示该菌可能呈现较高的基因多样性[24]。
本研究选择一对广泛使用的引物进行ERIC-PCR分型, 48株不同来源的C. jejuni共得到了31个基因型。除温江养鸡场1以外, 其他场均呈现丰富的基因多样性。具有相同基因型的菌株多来源于同一个场, 如来自温江活禽市场3的分离株V41、V42、V46、V47、V48, 同为E14型; 来自眉山鹌鹑养殖场的V17、V19、V20同为E26型。而少数基因型在不同场均有分布, 如温江活禽市场1、活禽市场3和雅安养鸡场同时有E15型分布。来自温江养鸡场1的V9、V10、V11、V12与来自眉山鹌鹑养殖场的V13、V14、V15、V16同为E28型, 表明不同地区、不同场来源的C. jejuni呈交叉分布, 这与薛峰等[13]的研究结果一致。ERIC-PCR分型结果表明, ERIC-PCR具有很高的异质性, 对于了解不同地区不同场菌株的流行特点具有重要的指导意义。
迄今为止, 人们对C. jejuni的致病机制尚不十分清楚。但已有研究证实了一些与该菌的致病性相关的基因及调控机制。本研究选择了目前国内外研究较多的17种毒力相关基因, 对分离的48株C. jejuni毒力相关基因的携带情况进行调查。趋化因子对于具有高度运动能力的C. jejuni来说不仅有利于其寻找更合适的生存环境, 且有利于其侵入宿主。本研究中趋化相关因子cheY和cheW的携带率在95%以上, 与翟海华等[12]的报道一致, 表明趋化作用在致病过程中可能具有重要的作用; 有研究证实作为C. jejuni主要毒力因子之一的 pVir 质粒上的 virBⅡ 的突变能引起细菌的黏附与侵袭率的下降, virBⅡ 质粒基因的平均携带率为 2.08%, 比张茂俊等[25]报道的低。其他一些毒力相关基因pldA、ciaB、iamA等的携带率低于国外Mü ller等[26]和Datta等[27]的报道, 与国内的研究报道具有较大差异, 说明不同宿主之间毒力基因的携带存在一定差异, 但是否对宿主致病, 还有待于进一步研究。本次调查中, 鹌鹑源的C. jejuni分离株毒力相关基因携带率普遍高于鸡源, 有72.92%的分离株携带有13种以上的毒力相关基因。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|