作者简介:宋西娇(1987—),女,山东临沂人,硕士,研究实习员,从事电镜服务工作。E-mail:songxijiao@yeah.net
2015年在浙江宁波发现感病马铃薯植株具有马铃薯花叶病的典型症状,即植株矮化,叶片花叶、皱缩。透射电镜负染色发现,其叶片中含有长度约600~900和400 nm的线状病毒粒子。超薄切片发现,病毒主要集中在叶肉细胞,产生的内含体包括病毒样粒子聚集体、串珠-片层内含体和柱状内含体。串珠-片层内含体代表马铃薯X属特征,柱状内含体代表马铃薯Y属特征,表明可能存在复合侵染,并且2种不同病毒引起的内含体被发现于同一细胞。使用马铃薯Y属病毒通用引物以及针对马铃薯X病毒设计的特异性引物进行RT-PCR扩增及测序,明确其为马铃薯Y病毒( Potato virus Y,PVY)和马铃薯X病毒( Potato virus X,PVX)复合侵染。
In 2015, an infected potato plant was found in Zhejiang Ningbo, which had the typical symptom of dwarf and mosaic leaf was thought to be a potato viral disease. Two kinds of linear virus particles with the typical length of 600-900 and 400 nm were observed under transmission electron microscopy by the negative staining of infected potato leaves. Ultra-thin section revealed that viral products were accumulated in the mesophyll cells. Except for observing the virus like particles in cytoplasm, two other kinds of inclusion bodies could also be observed in one cell including the cylindrical inclusion (CI) body and the laminated inclusion component (LIC), which was induced by two kinds of different viruses, CI induced by Potyvirus and LIC induced by Potexvirus, implying a doubly infected in this plant. To verify the pathogen, a molecular assay was performed by RT-PCR and sequencing, by using of the universal primers of Potyvirus and the specific primers of Potexvirus. At last, with the positive results of pathogenic diagnosis, we confirmed that this sick potato was induced by a synergistic infection with two viruses of potato virus X(PVX) and potato virus Y (PVY).
马铃薯是重要的粮食作物和经济作物, 在世界各地广泛种植。马铃薯生产受病害威胁严重, 病毒病是其中较主要的一种病害。人们对马铃薯病毒病的研究工作已较为深入, 尤其在主产区西欧, 已达到进行综合防治的程度。近年来, 随着我国粮食战略的调整, 马铃薯被列为我国第四大粮食作物, 因此, 马铃薯病害研究也被提升到了粮食安全的战略高度。生产中常见的马铃薯病毒病原主要有:马铃薯卷叶病毒(Potato leafroll virus, PLRV)、马铃薯X病毒(Potato virus X, PVX)、马铃薯Y病毒(Potato virus Y, PVY)、马铃薯S病毒(Potato virus S, PVS)、马铃薯A病毒(Potato virus A, PVA)、马铃薯M病毒(Potato virus M, PVM)、马铃薯V病毒(Potato virus V, PVV)、黄瓜花叶病毒(Cucumber mosaic virus, CMV)、烟草花叶病毒(Tobacco mosaic virus, TMV)、烟草脆裂病毒(Tobacco rattle virus, TRV)和番茄黑环病毒(Tomato black ring virus, TBRV)等[1, 2]。由PVX引起的马铃薯轻花叶病, 症状为花叶, 叶片不皱缩不坏死; 而马铃薯重花叶病症状为重度花叶和叶片皱缩, 叶脉坏死, 该病由PVY单独侵染或与别的病毒复合侵染引起, 如PVY+PVX或PVY+PVA。复合侵染比单个病毒侵染时造成的危害更大, 有研究表明, PVX复合侵染比单独侵染时复制能力增强, 病毒含量大幅提高, 并造成症状加重[3]。中国马铃薯生产受病毒病危害非常严重, 在各主要产区如黑龙江、河南等地多为复合侵染[4, 5, 6]。
目前可行的抗病毒方法是使用脱毒苗及培育抗病品种[7], 而可靠的病原鉴定是病毒防控的前提[8]。常用的病原检测手段包括血清学技术[6]、分子生物学技术[9]和电镜技术[3, 10]等。血清学技术基于特定病毒的抗体进行检测[11], 兼顾准确度与可操作性, 是优秀的病原诊断最终确认手段。分子生物学技术基于特定病毒序列的引物进行检测, 具有非常好的准确性和灵敏度, 是最佳的病原诊断最终确认手段。电镜技术中的负染色技术可以快速观察病样中可能存在的病毒粒子, 依据形态初步判断病毒粒子有无及类型。超薄切片技术可以观察病毒引起的细胞病理学变化, 依据特征内含体进行病原诊断, 大致判断病毒属于哪个科、属。田间样品电镜观察可为下一步诊断提供有效指导。日常诊断中往往多种方法配合使用, 其中负染色和超薄切片用于前期研究确定诊断方向, 免疫学和分子生物学技术用于最终确定病原。
浙江省马铃薯栽培面积不大, 但也受病毒病严重危害, 有关浙江省马铃薯病毒病受哪种病原侵害一直没有明确报道。2015年在宁波地区发现了马铃薯花叶病症状的马铃薯植株。我们综合运用负染色技术、超薄切片技术和分子生物学手段进行检测, 确认感病马铃薯的病原是PVX和PVY, 二者复合侵染致病, 现将结果报告如下。
马铃薯病株采自浙江宁波。实验使用针对Potyvirus的通用引物Sprimer、M4和M4T以及针对PVX的引物PVX-CP-F、PVX-CP-R, 均由浙江省农业科学院郑红英副研究员惠赠。RNA提取用Trizol试剂和SuperScript III Reverse Transcriptase逆转录酶, 购自Invitrogen公司; Ex Taq DNA聚合酶购自Takara公司; 凝胶回收QIAquick Gel Extraction试剂盒购自QIAGEN公司; T4 DNA连接酶和pGEM T-载体购自Promega公司; 其余药品试剂均为进口分析纯。
选取新鲜的马铃薯病叶, 按照Invitrogen Trizol试剂盒的操作说明提取总RNA。以总RNA为模板, 使用针对Potyvirus的特异引物M4T(特异性结合基因组3’ 末端polyA结构)(5’ -GTTTTCCCAGTCACGAC(T)15-3’ )进行反转录反应合成第一链cDNA[12]。以cDNA为模板, 使用针对Potyvirus属特异引物对Sprimer(5’ -GGXAAYAAYAGYG-GXCAZCC-3’ , X=A, G, C或T; Y=T或C; Z=A或G)和M4(5’ -GTTTTCCCAGTCACGAC-3’ ), 用Ex Taq DNA聚合酶进行PCR反应扩增获得病毒基因组的部分片段。以相同总RNA为模板, 使用针对PVX外壳蛋白基因的引物PVX-CP-R(5’ -TTATGGTGGTGGTAGAGTGA-3’ )进行反转录反应, 使用引物对PVX-CP-F(5’ -CATGAAGGTGCCCACAGAC-3’ )、PVX-CP-R和Ex Taq DNA聚合酶进行PCR反应扩增。扩增产物经凝胶回收试剂盒回收纯化后用T4 DNA连接酶与pGEM-T载体进行连接, 连接产物转化TG1感受态细胞, 经蓝白斑反应筛选重组质粒。将阳性重组质粒送测序公司进行测序, 测序结果递交NCBI/DDBJ/GenBank数据库, 与数据库存储数据经BLAST比对分析确定同源性。
马铃薯病叶研磨, 铜载网蘸取组织汁液, 用2%磷钨酸(pH 6.7)负染色, 滤纸吸干。在Hitachi H-7650型透射电镜下观察, 加速电压80 kV, Gatan 830型侧插CCD相机记录图像。
选取经分子鉴定为PVX和PVY复合侵染的马铃薯病叶进行电镜样品制备, 方法参照文献[13]。叶片花叶区域切成2 mm2见方的小块, 常规戊二醛-四氧化锇双固定, 磷酸缓冲液漂洗, 乙醇梯度脱水, 丙酮替代, Spurr树脂包埋聚合。制备完成的树脂包埋块样品在Leica UC6型超薄切片机下进行超薄切片, 覆膜铜载网捞片; 切片经柠檬酸铅和醋酸铀双染色, 置于Hitachi H-7650型透射电镜下观察, 加速电压80 kV, Gatan830型侧插CCD相机记录图像。
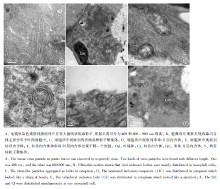
2015年在宁波市农业科学院试验田内发现带病马铃薯植株, 呈现植株矮化、褪绿等症状。与健康叶片相比, 病叶尺寸变小, 呈现花叶褪绿、皱缩扭曲、叶脉坏死等典型马铃薯花叶病症状(图1), 依据新叶褪绿等宏观症状判断有可能是病毒病。
为了初步判断病毒类型, 将马铃薯病叶汁液经负染色透射电镜检查, 观察到弯曲线状病毒粒子, 直径为12 nm(图2-A), 长度可分为400 nm左右和600~900 nm两类。从这些病毒粒子形态推测病原可能是马铃薯Y病毒属(Potyvirus)的成员, 不排除含有2种或2种以上线状病毒复合侵染的情况, 需要结合病理特征进一步辅助诊断。
使用超薄切片和细胞病理学手段对感病叶片进行观察, 发现病毒侵染产生的内含体主要集中在叶肉细胞的细胞质(图2-B)。在感染细胞中能观察到以下类型的内含体:线状病毒样粒子聚集体(图2-C), 串珠-片层状内含体(laminated inclusion component, LIC)(图2-D), 柱状内含体(cylindrical inclusion, CI)(图2-E)。病毒样粒子多以近似平行的方式成束排列, 相互之间少有交错(图2-C)。串珠-片层内含体整体尺寸较大, 从细节上看是由厚度为3 nm的片层围绕卷曲而成, 片层上附着有直径11~14 nm的高电子密度的小颗粒, 颗粒附着在片层上的方式有单面附着和双面附着2种(图2-D)。柱状内含体从横截面观察, 其旋臂围绕一个中心呈伸展的旋转辐射状排列, 形似风轮(图2-E)。从纵截面观察, 柱状内含体的臂呈长线状或片层状, 整体侧面形似柱子。在细胞质中没有观察到卷筒体。依据上述柱状内含体的形态结构:即仅出现风轮形状的柱状内含体, 无卷筒体等特征可判定其为Ⅰ 型柱状内含体[14, 15]。在同一细胞中发现了柱状内含体和串珠-片层内含体(图2-F), 表明复合侵染也发生在同一细胞内。柱状内含体是Potyvirus成员的特征, 而串珠-片层内含体是马铃薯X病毒属(Potexvirus)成员的特征。因此, 判断感病植株为复合侵染, 病原可能是Potyvirus成员以及Potexvirus成员。这2个类群包含多种病毒种类, 明确病原种类需要进一步的分子证据。
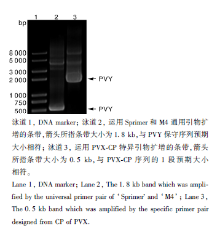
用Potyvirus病毒通用引物Sprimer和M4对感病马铃薯叶片提取的总RNA进行RT-PCR检测, 扩增出的条带经电泳检测长度约1.8 kb(图3), 与预期长度为1.8 kb包含NIb、CP基因和3’ -UTR区的片段大小相符。
测序结果显示, 该片段长度为1 752 bp。BLAST序列比对分析表明, 该病毒序列与NCBI/DDBJ/GenBank数据库收录的PVY核苷酸序列同源性为99%。与此同时, 用引物PVX-CP-F和PVX-CP-R对相同马铃薯叶片中提取的总RNA进行RT-PCR检测, 扩增条带为0.5 kb(图3), 与Potexvirus病毒外壳蛋白基因片段的预期大小相符, 测序显示片段为515 bp。经BLAST序列比对分析表明, 与PVX的外壳蛋白基因核苷酸序列同源性为97%。综上, 认为PVX和PVY是宁波地区马铃薯花叶病的病原, 二者复合侵染致病。
2种或2种以上不相关的病毒复合侵染同一寄主是病毒侵染过程中的常见现象。由于复合侵染时2种病毒的相互作用, 包括协生(增加病毒含量)或拮抗(减少病毒含量), 会导致寄主产生的症状与单独侵染不同。例如玉米褪绿斑驳病毒(Maize chlorotic mottle virus, MCMV)与小麦线条花叶病毒(Wheat streak mosaic virus, WSMV)复合侵染时比单独侵染引起的褪绿症状更重, 并导致MCMV病毒含量的急剧上升[16]。水稻黑条矮缩病毒(Rice black streaked dwarf virus, RBSDV)与水稻条纹病毒(Rice stripe virus, RSV)均为灰飞虱传播的病毒, 也能造成复合侵染, 但对寄主水稻的症状没有明显的影响[17]。Potexvirus成员和Potyvirus成员的协生复合侵染也是经典案例[3], 已明确这2种病毒之间存在协生关系。除了PVX和PVY能造成复合侵染外, PVX也能与其他众多Potyvirus成员进行复合侵染, 包括烟草脉点斑驳病毒(Tobacco vein mottle virus, TVMV)、烟草蚀纹病毒(Tobacco etch virus, TEV)和辣椒斑驳病毒(Pepper mottle virus, PepMoV)[18]。PVX/PVY复合侵染协生的机理是PVY基因组编码的一个病程蛋白HC-Pro(作用是症状表现及控制复制)会在复合侵染中影响PVX核酸的复制, 从而导致症状的增强和PVX病毒含量的提高[19]。本研究发现, PVX/PVY复合侵染马铃薯时, PVX病毒蛋白形成的串珠-片层内含体远多于PVY蛋白形成的柱状内含体, 这个情况与文献报道HC-Pro加强PVX复制的情况一致[20]。
电镜技术是重要的病原诊断手段之一, 很早就用于鉴定筛选马铃薯无毒苗[10]。在病原诊断中, 细胞病理学观察不仅能够观察到病毒产生的内含体, 以此作为病毒分类依据, 为诊断提供指导, 还可以观察到寄主植物受病毒侵染产生的变化, 从而从细胞病理学水平揭示植物-病原互作的相关信息。本研究发现, 2种病毒PVX和PVY复合侵染发生在同一个细胞内, 是这2种病毒之间紧密的协生关系在细胞水平上的表现。对某些其他病毒复合侵染的研究发现, 多数复合侵染不发生在同一个细胞内, 代表不同病毒侵染的2种特征性内含体分别发现于不同的细胞。例如菜豆黄花叶病毒(Bean yellow mosaic virus, BYMV)和蚕豆萎蔫病毒2号(Broad bean wilt virus 2, BBWV 2)复合侵染蚕豆时, 会在相邻的叶肉细胞中分别产生病毒产物[13]。甘薯羽状斑驳病毒(Sweet potato feathery mottle virus, SPFMV)和甘薯褪绿矮化病毒(Sweet potato chlorotic stunt virus, SPCSV)复合侵染甘薯则发生在不同组织, SPFMV在叶肉组织, 而SPCSV在维管束[21]。也有复合侵染发生在同一细胞的报道, 例如MCMV和甘蔗花叶病毒(Sugarcane mosaic virus, SCMV)的复合侵染[22]。复合侵染中2种病毒在同一细胞和不同细胞内的侵染过程对致病有什么具体影响, 还需要进一步研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|