作者简介:安玉兰(1995—),女,重庆人,硕士研究生,主要从事蔬菜分子生物学研究。E-mail:2693682953@qq.com
为探究黄瓜 CsMADSs的功能,构建了黄瓜 CsMADS08及 CsMADS21基因的真核表达载体并转化烟草,研究其在烟草中的亚细胞定位;同时通过农杆菌介导法转化拟南芥,经潮霉素筛选及分子检测,获得阳性株,观察转基因后代植株的表型变化情况;实时荧光定量PCR检测 CsMADS08和 CsMADS21在转基因后代植株各器官中的表达情况。结果显示,CsMADS08定位于细胞膜和细胞核上,而CsMADS21定位于细胞膜上。表型分析结果显示,过表达 CsMADS08基因的拟南芥叶片发紫,侧枝少,且侧枝上出现莲座状的茎生叶;而过表达 CsMADS21植株的侧生花序及果荚都比野生型多,且花期早,果实成熟早。荧光定量PCR结果显示, CsMADS08基因主要在茎中表达,而 CsMADS21基因则主要在花中有高表达。该研究可为进一步明确黄瓜 CsMADSs基因的功能及培育黄瓜新品种提供参考依据。
To investigate the CsMADSs genes which have influence on the growth and development of Arabidopsis thaliana, the eukaryotic expression vectors of CsMADS08 and CsMADS21 genes were constructed and transformed into tobacco to study their subcellular localization. At the same time, the eukaryotic expression vectors were transformed into Arabidopsis through Agrobacterium, and the positive transgenic plants were obtained. Meanwhile, phenotypic changes were observed in transgenic plants, and the expression of CsMADS08 and CsMADS21 were detected by real-time fluorescence quantitative PCR. The results showed that CsMADS08 was positioned on cell membrane and nucleus, while CsMADS21 was positioned on the cell membrane. In addition, purple leaves, fewer branches, and lotus leaves were detected on the lateral branch in the CsMADS08 transgenic plants. On the other hand, there were much more lateral inflorescences and pods, and also earlier flowering and fruits in the CsMADS21 transgenic plants than those of the wild plants. The fluorescent quantitative PCR results showed that CsMADS08 gene was expressed in the main stem, while CsMADS21 gene was mainly expressed in the flowers. The results provided a reference basis for further studying the function of CsMADSs genes and breeding new varieties of cucumber.
黄瓜(Cucumis sativus L.)是葫芦科一年生攀援草本植物, 是夏季主要蔬菜之一, 全国各地均有栽培。MADS-box家族基因是一类编码转录因子的基因, 在植物生长发育过程中起重要的调控作用。研究表明, MADS-box家族基因在植物根的营养吸收、分生组织分化、春化、开花时间[1]、胚的发育及果实成熟[2]等方面发挥着重要作用[3, 4, 5]。其中, 研究较多的是MADS-box基因参与花器官及果实的发育[6, 7, 8]。如过量表达BrAGL20基因能促进油菜提早开花[9]; 刘励蔚等[10]采用花粉管通道法将白桦花发育基因BmMADS3导入玉米自交系中, 能使玉米花期提前, 与产量相关的性状如穗重、穗长、穗粗和百粒重等均显著提高; 位伟强等[11]从洛阳红牡丹花芽中克隆得到1个开花调控转录因子基因PsFUL1, 其在牡丹花芽和花瓣中表达量最高, 在其他器官中表达水平较低或不表达。拟南芥的MADS-box基因有100多个, 其在花器官的发育中发挥着重要作用[12], 但超过80%的MADS-box基因功能是未知的[13]。因此, 越来越多的研究人员开始关注MADS-box基因在花器官发育以外的功能。近年来, 已发现MADS-box基因在植物花色素苷合成[14]、抗逆性[15, 16]、根结构、芽休眠[17]、叶片发育方面都发挥着重要的作用。番茄AGAMOUS-LIKE1基因参与番茄果皮的形成, 沉默TAGL1基因会明显降低番茄果皮厚度和硬度[18]。Yu等[19]认为AGL21能够促进拟南芥侧根的伸长, 从而调控侧根发育。葡萄MADS-box家族的FUL同源基因(AP1及VFUL-L)能促进葡萄卷须的分化与发育[20, 21]。SLMBP11(AGL15亚家族成员)能显著降低番茄的株高、叶面积、节间长度, 增加叶腋的分枝数、节点和叶片数[22]。目前, 有关黄瓜MADS-box家族基因的研究较少, 主要集中在调控黄瓜花器和果实发育方面。龚霞峰[23]研究表明, 抑制黄瓜CUM1基因(AGAMOUS同源基因)的表达会延迟黄瓜开花, 而过表达CUM1会使黄瓜花的雄蕊退化, 推测CUM1基因可能参与黄瓜雄蕊和心皮的发育。过表达ERAF17基因(受乙烯诱导表达的控制植物花器发育的MADS-box基因)的黄瓜植株只产生雄花, 没有雌花生成[24]。王鑫[25]以EMS诱变得到的黄瓜花器和果实发育的突变体为材料, 结合高通量测序分析, 定位了1个黄瓜花发育相关的基因CsSEP2(Csa4G126990)。课题组前期研究表明, 黄瓜CsMADS08(Csa4G126480.1)基因在各器官都有表达, 而CsMADS21(Csa6G367090.1)主要在叶、花及幼果中表达[26, 27], 但CsMADSs基因的生物学功能仍然未知。本研究构建黄瓜CsMADSs(CsMADS08和CsMADS21)基因的真核表达载体, 通过农杆菌介导转化烟草, 利用荧光共聚焦显微镜检测CsMADSs基因在烟草细胞中的定位; 同时通过花序侵染转化拟南芥, 检测转基因后代拟南芥的表型变化, 并研究CsMADSs在过表达拟南芥植株中的表达情况, 为进一步探讨黄瓜CsMADSs基因的功能提供理论依据。
津绿1号黄瓜(天津市绿丰园艺新技术开发有限公司)购自合肥先锋种业, 拟南芥、烟草种子、pCAMBIA1305载体与P19菌株由安徽农业大学生命科学学院作物生物学重点实验室提供。大肠埃希菌JM109感受态细胞、农杆菌感受态细胞、凝胶回收试剂盒、植物基因组DNA提取试剂盒及质粒提取试剂盒购自北京全式金生物技术有限公司。限制性内切酶购自宝生物工程(大连)有限公司。引物由生工生物工程(上海)股份有限公司合成。其他试剂购自生工生物工程(上海)股份有限公司。
1.2.1 CsMADSs基因克隆
采用Trizol试剂法提取黄瓜叶片总RNA, 反转录成cDNA。用引物P1/P2和P3/P4(表1)分别扩增CsMADS08和CsMADS21序列, 回收目的片段。连接pMD19-T载体, 转化大肠埃希菌JM109感受态细胞, 提取质粒进行酶切验证, 取阳性克隆送生工生物工程(上海)股份有限公司测序。
| 表1 CsMADSs、Gus及Hyg基因扩增的引物序列及其参数 Table 1 Primer sequences and parameters of CsMADSs, Gus and Hyg |
1.2.2 过表达载体构建及农杆菌遗传转化
利用BglⅡ 、SalⅠ 双酶切pCAMBIA1305-GFP载体[28], 回收大片段; 利用BamHⅠ 、SalⅠ 双酶切质粒pMD19-T-CsMADSs, 回收小片段CsMADSs。采用T4连接酶连接过夜, 连接液转化大肠埃希菌JM109, 经筛选获得重组质粒pCAMBIA1305-CsMADS08及pCAMBIA1305-CsMADS21。冻融法转化农杆菌EHA105。挑取农杆菌单克隆提取质粒, 并进行PCR验证。挑选阳性克隆摇菌, -70 ℃冰箱保存, 用于瞬时转化烟草和侵染拟南芥。
1.2.3 亚细胞定位
取pCAMBIA1305-CsMADSs农杆菌菌液及P19菌株分别摇菌, 并按比例混合菌液, 离心10 min, 收集菌体。加入2 mL处理液(0.5 mol· L-1 MES 200 μ L, 1 mol· L-1 MgCl2 100 μ L, 100 mmol· L-1 乙酰丁酮10 μ L, 加水至10 mL), 吹打混匀, 然后注射6叶期的烟草叶片, 湿润避光环境下培养36~48 h。取烟草幼叶, 切割成0.5 cm × 0.5 cm, 平铺在载玻片上, 加几滴蒸馏水盖好盖玻片并轻压片, 置于共聚焦显微镜下扫描拍摄(激发光波长488 nm, 发射光波长520~550 nm), 观察GFP在烟草叶片细胞的分布。
1.2.4 拟南芥种植及侵染
营养土和蛭石按体积比1∶ 3混匀装盆, 播种拟南芥, 待其抽薹开花后进行侵染。
取100 μ L农杆菌菌液, 加入45 mL的YEP培养基, 培养至D值为0.8。4 ℃ 4 000 r· min-1 离心10 min, 取菌体加入Buffer(MS 0.11 g, 蔗糖2.5 g, MES 0.025 g溶于50 mL纯水, 调节pH值至5.7, 加入15 μ L表面活化剂Silwet-77, 磁力搅拌30 min。)吹打混匀, 侵染拟南芥花序, 并套袋, 共侵染2~3次。待种子成熟进行采收(T1代), 置于37 ℃烘干, 4 ℃保存。
1.2.5 转基因拟南芥的筛选及表型观测
称取30 mg T1代种子, 75%乙醇消毒1 min, 再用灭菌水清洗3次, 然后用0.1%灭菌琼脂糖悬浮种子, 均匀平铺于含30 mg· L-1潮霉素的MS培养基上。以野生型为对照。待植株长到6片叶时, 将长势强的抗性植株移栽到盆中。7 d后, 利用DNA提取试剂盒提取叶片基因组DNA, PCR扩增潮霉素抗性基因Hyg、Gus报告基因及目的基因CsMADS08和CsMADS21。经检测呈阳性的植株按单株收获种子(T2代), 其余后代按同样方式筛选种植直至获得纯合植株, 观察和鉴定各世代植株的表型。
1.2.6 转基因拟南芥CsMADSs的表达分析
采用Trizol法提取T3代转基因拟南芥及野生型拟南芥花期各器官(根、茎、叶、花)的总RNA, 用微量核酸测定仪(ND2000)及琼脂糖凝胶电泳检测RNA的纯度及浓度。用反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser除去基因组DNA, 并进行反转录反应。实时荧光定量PCR反应按照SYBR Premix Ex Taq Ⅱ (宝生物染料法荧光定量试剂盒)说明书进行。反应体系如下:SYBR Green Master mix 12.5 μ L, 上游引物(10 μ mol· L-1)1.0 μ L, 下游引物(10 μ mol· L-1)1.0 μ L, cDNA原液0.9 μ g, 加RNase free H2O至25 μ L。以拟南芥Actin2(AT3G18780)基因为内参, 引物序列见表1。实时荧光定量PCR反应条件为:50 ℃ 2 min; 95 ℃ 10 min, 95 ℃ 15 s, 60 ℃ 1 min, 40个循环。每个试样重复4次, 以非转化株为对照。qPCR结果采用2-Δ Δ Ct法计算。
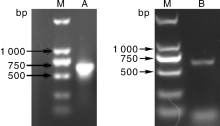
提取黄瓜叶片总RNA, 经反转录成cDNA, 分别以P1/P2和P3/P4为引物, 扩增得到约650 bp的片段, 回收目的片段, 连接pMD19-T载体, 经测序得到的CsMADS08和CsMADS21长度分别为633 bp和645 bp。利用BamHⅠ 、SalⅠ 双酶切质粒pMD19-T-CsMADSs, 连接到经BglⅡ 、SalⅠ 双酶切的pCAMBIA1305载体中, 转化农杆菌EHA105, 提取质粒进行PCR验证。结果(图1)表明, 目的基因已经成功连接到pCAMBIA1305载体中。
利用激光共聚焦显微镜观测CsMADSs在烟草叶片细胞中的定位情况。结果(图2)显示, CsMADS08定位于细胞膜和细胞核上(图2-A), CsMADS21定位于细胞膜上(图2-B), 对照pCAMBIA1305空载体定位于细胞膜和细胞核上(图2-C)。
取T1代拟南芥种子, 经消毒后平铺于含30 mg· L-1潮霉素的MS培养基中, 以野生型为对照。结果发现, 野生型植株均出现黄化直至死亡, 大部分T1代植株表现出与野生型相似的表型, 只有少数植株生长正常。将生长健壮的植株移栽于营养钵中, 精细管理, 供后续检测。
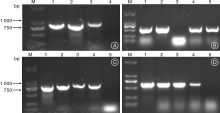
提取潮霉素抗性植株的叶片DNA, PCR分别扩增潮霉素抗性基因和Gus基因。其中, 转CsMADS08基因的抗性植株, 利用潮霉素抗性基因及CsMADS08基因进行PCR检测, 结果显示有目的条带(图3-A, 3-C)。转CsMADS21的抗性植株, 利用潮霉素抗性基因、CsMADS21及Gus报告基因进行PCR检测, 分别得到相应的扩增条带(图3-B, 3-C, 3-D)。
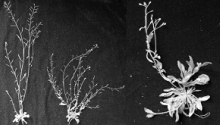
在T2、T3代转基因拟南芥植株中, 过表达CsMADS21的拟南芥植株, 主茎的花序发育比野生型早5~6 d(图4-A); 同时植株叶片颜色加深, 呈紫色(图4-B), 且侧枝数增加, 侧生花序及果荚数都较野生型多(图4-D)。而过表达CsMADS08的拟南芥植株, 幼苗期出现大量的莲座叶, 同时侧枝上出现大量莲座状丛生叶片(图4-C), 甚至果荚成熟后, 依然有新的莲座状的茎生叶抽出(图4-E), 侧枝数减少, 果荚数减少(图4-D); 植株也出现叶片颜色加深, 呈紫色。提取过表达转基因拟南芥及野生型拟南芥叶片的花青素, 结果显示, 过表达植株叶片的花青素含量均比野生型高, 达到显著差异(结果未列出)。
与野生型植株相比, T4代转CsMAD08的拟南芥植株出现了表型分化。一种表现为株型矮化、分枝数多, 分枝细弱; 另一种则出现植株莲座叶增多, 茎上着生莲座状叶片, 叶片多而分枝少的现象(图5)。
采用Trizol法提取T3代植株各器官总RNA, 反转录成cDNA, 实时荧光定量PCR检测CsMADS08和CsMADS21的表达情况。结果表明:过表达CsMADS08的拟南芥植株, 目的基因在茎中表达量较高, 在其他器官中的表达量较低(图6-A); 过表达CsMADS21的拟南芥植株, 目的基因在花中表达量较高, 在根、茎、叶中表达量较低(图6-B)。
过表达CsMADS08的拟南芥植株, 主茎刚抽出时, 其莲座叶数目增加, 茎生叶也呈现丛生状。花序抽生时, 侧枝数目少, 果荚较野生型瘦弱, 株型较矮。在生长后期, 侧枝上出现大量的莲座状叶片, 侧枝果荚数目少, 果荚较短, 较瘦瘪。在野生型植株完全成熟后, 同期过表达CsMADS08的拟南芥植株侧枝上还会有新的莲座叶出现。过表达CsMADS08的T4代植株表型出现了分化, 一种株型矮化、分枝多, 枝条细弱, 而另一种则表现为莲座叶数目增多而分枝减少。说明CsMADS08基因可能参与调控植株腋芽的分化方向, 分化形成更多的叶片; 由于植株不断产生莲座状叶片, 致使营养流向新生的幼叶, 造成植株分枝数减少, 开花和结荚数也相应减少, 果实得不到足够的养分供应, 所以果实瘦弱干瘪。该研究结果与Guo等[22]的结果相似, 其研究结果表明番茄MADS-box基因SLMBP11(AGL15亚家族的成员)能显著降低株高、叶面积、节间长度, 而叶腋的分枝数、节点和叶片数都增加, 推测该基因可能调控腋芽的生长。黄瓜CsMADS08基因如何调控腋芽的生长还有待进一步验证。相反, 过表达CsMADS21的拟南芥植株, 其主茎开花结果比野生型早5~6 d, 侧枝数目增加, 花序较多, 结荚率高, 果荚饱满。说明CsMADS21可能参与花芽的分化、形成及果实的发育, 相关的后续研究正在进行。前期研究结果表明, 黄瓜CsMADS08及CsMADS21属于AP1-FUL类的MADS-box基因, 而且与拟南芥的AtAGL7、AtAGL8及AtAGL79具有较高的同源性[23]。有报道认为, AGL8在拟南芥的果实发育及叶片形状方面起调控作用[29], 黄瓜CsMADS21的结果与此相似, 但CsMADS08的结果与此不同。AtAGL7及AtAGL79对拟南芥生长发育的影响尚未见报道。褚婷婷等[30]研究了拟南芥AP1-FUL类基因的表达调控模式, 发现FUL启动子的上游存在2个抑制其表达的顺式作用元件, 且FUL基因的第1个内含子参与拟南芥心皮核雄蕊的发育调控。
MADS-box作为一类重要的转录调控因子, 参与植物许多重要的生物学过程, 尤其在花及果实的发育成熟过程中起重要作用。Yin等[31]研究了SIMBP8基因在番茄各器官的表达情况, 发现其在番茄的老叶、萼片及后期的果实中高表达, 进一步研究发现, SIMBP8干涉转基因植株的果实能产生较高的乙烯, 其成熟时间比野生型提前2~4 d, 说明SIMBP8对番茄果实后熟软化起重要作用。本试验中, 过表达CsMADS08的拟南芥植株, 目的基因在茎中有较高的表达量, 在其他器官中表达量较低, 这可能与CsMADS08参与控制腋芽的分化以及莲座叶的形成相关, 这与Guo等[22]的研究结果类似。CsMADS08对茎或侧枝的生长可能起着负调控作用, 促使腋芽分化形成更多的叶片, 导致植株的营养大多流向新生的叶片, 造成植株分枝少、结荚少。而过表达CsMADS21的拟南芥植株, 目的基因在花中有较高的表达量, 而在根、茎、叶中表达量较低, 该结果与之前各世代在表型上的特征相一致, 花期提前、花序多、结荚率高及果荚饱满等, 进一步说明CsMADS21可能参与花的分化及果实的发育。至于CsMADS08和CsMADS21在黄瓜生长发育过程中的调控作用还有待于进一步研究。
(责任编辑 侯春晓)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|