作者简介:王露(1992—),女,湖北钟祥人,硕士研究生,主要从事应用微生物学研究。E-mail: 387607361@qq.com
加纳链霉菌( Streptomyces ghanaensis)是动物饲料添加剂黄霉素的主要生产菌。建立高效稳定的遗传操作系统是对该菌进行分子生物学研究和构建高产黄霉素基因工程菌的基础。以含有基因整合型重组质粒pIJ8630- nsdA的 Escherichia coli ET12567/pUZ8002为供体、加纳链霉菌ATCC 14672为受体进行接合转移,通过单因素试验与正交试验对接合转移过程中的关键影响因素进行优化。结果表明,WL50培养基为接合转移最适培养基,当受体加纳链霉菌ATCC 14672孢子在50 ℃条件下热激10 min、37 ℃预培养3 h后,与供体按细胞数比例1∶15混合后涂布于接合转移平板上,30 ℃培养14 h后覆盖50 μg·mL-1安普霉素和500 μg·mL-1萘啶酸时,接合频率最高,比优化前提高20.3倍。
Streptomyces ghanaensis is the main producer of the animal feed additive flavomycin. Establishment of a highly efficient genetic manipulation system is foundamental for molecular biology study and construction of efficient flavomycin-producing strains by genetic engineering. With the assistance of the helper plasmid pUZ8002, pIJ8630- nsdA was transferred from the donor strain E.coli ET12567 to the recipient S. ghanaensis ATCC 14672 by intergeneric conjugation. The key factors in the process of conjugational transfer were optimized by single factor experiment and orthogonal test. The results showed that WL50 medium was the optimal medium for conjugational transfer. The conjugation frequency reached the highest as follows: The spores of S. ghanaensis ATCC 14672 were heat-shocked at 50 ℃ for 10 min and pre-cultured at 37 ℃ for 3 h first. Secondly, they were mixed well with the donor in a ratio of 1∶15 and spreaded on the conjugation plates, incubated at 30 ℃ for 14 h. Thirdly, they were covered with 50 μg·mL-1 apramycin and 500 μg·mL-1 nalidixic acid. The optimized conjugational frequency was 5.35×10-6, which was increased by 95.3%.
黄霉素, 又称黄磷脂醇、默诺霉素、班堡霉素, 是一种磷酸糖脂类抗生素, 是目前唯一已知的能直接抑制肽聚糖糖基转移酶的抗生素[1]。黄霉素具有促进动物生长、在动物体内和农畜产品中无残留、对环境无污染、不易产生耐药性等优点。2001年, 原农业部颁布的《饲料药物添加剂使用规范》中允许黄霉素预混剂作为饲料药物添加剂使用。黄霉素杀菌作用较强, 不与其他常用抗生素产生交叉抗性, 能够抑制动物肠道中革兰氏阳性病原菌。2002年, 原农业部正式批准黄霉素预混剂为新兽药[2]。加纳链霉菌是黄霉素的主要生产菌。近年来, 对黄霉素的研究主要集中在通过分子遗传学或者化学方法改造加纳链霉菌结构、改良其药代动力学特性方面[3], 为黄霉素的应用奠定了基础。
在利用分子生物学技术进行加纳链霉菌基因改造的过程中, 建立高效稳定的遗传操作系统是关键, 但国内外有关加纳链霉菌遗传操作系统方面的研究鲜见报道。目前, 接合转移是大肠埃希菌与链霉菌之间最常用的基因转移技术。本文研究接合转移培养基、孢子预萌发条件、接合体系中供体菌与受体菌的浓度比, 以及抗生素添加时间, 选择最适条件, 建立并优化大肠埃希菌-加纳链霉菌接合转移体系, 为深入开展该菌的分子遗传操作、提高该菌产生黄霉素的能力奠定基础。
1.1.1 菌株和质粒
加纳链霉菌(Streptomyces ghanaensis)ATCC 14672、大肠埃希菌(Escherichia coli)DH5α 、E. coli ET12567(pUZ8002)均由本实验室保藏。质粒pMD-19购自TaKaRa公司。质粒pIJ8630由浙江大学李永泉教授惠赠。质粒pIJ8630-nsdA在pIJ8630的基础上构建。
1.1.2 酶和试剂
安普霉素(Apr)、硫链丝菌素(Tsr)、链霉素(Str)、卡那霉素(Km)、氯霉素(Cm)、氨苄西林(Amp)、萘啶酸(NA), 购自生工生物工程(上海)股份有限公司; rTaq、XbaⅠ 限制性内切酶、T4 DNA连接酶、DNA分子量标准物均购自TaKaRa公司; FastAP购自Thermo公司。
1.1.3 培养基
大肠埃希菌培养基为2× YT[4]; 加纳链霉菌液体培养基为TSB, 固体培养基为YMS、2CMY、MM、AS-1、MS、改良高氏一号(简称RG)和TSB固体, 配方参见文献[5, 6]。接合转移培养基WL50(g· L-1):可溶性淀粉5, 氯化钠2.5, 硫酸镁3.6, 氯化镁4.8, 酵母浸出粉1, 丙氨酸0.2, 精氨酸0.2, 天冬酰胺0.5, 琼脂20, pH值7.5(灭菌前), 115 ℃灭菌30 min。
1.2.1 基本遗传操作
加纳链霉菌ATCC 14672的培养方法参见文献[7]。大肠埃希菌培养方法、感受态的制备及DNA转化方法参照《分子克隆实验指南》[4]。加纳链霉菌总DNA的提取方法和接合转移频率的计算方法参照《链霉菌遗传操作手册》[5]。
1.2.2 重组质粒pIJ8630-nsdA构建
以加纳链霉菌ATCC 14672基因组为模板, 采用特异性引物nsdA-F: 5’ -GGGCTCTAGAGTGAGCGGCAACGGCGG-3’ 和nsdA-R: 5’ -CCAATCTAGATGGCATGGGGGAGCCGAG-3’ (下划线为Xba Ⅰ 酶切位点), PCR扩增长度1 590 bp的nsdA基因。进行TA克隆, 转化E. coli DH5α , 经测序验证后提取质粒, XbaⅠ 酶切回收nsdA基因片段。经XbaⅠ 单酶切、去磷酸化后的pIJ8630线性质粒用T4 DNA连接酶与nsdA基因片段连接, 转化E. coli DH5α , PCR验证Apr抗性平板上的阳性克隆。转化子送生工生物工程(上海)股份有限公司测序。检测引物序列为:CK-F, 5’ -CGACTCGGCTCCCCCATGCC-3’ ; CK-R, 5’ -AACGCCAGCAAC GCGGCC-3’ 。
1.2.3 重组质粒pIJ8630-nsdA转化E. coli ET12567(pUZ8002)
将重组质粒pIJ8630-nsdA转化到E. coli ET12567(pUZ8002)感受态细胞中, 利用Apr、Cm、Km抗性平板筛选抗性菌落, 再以特异性引物PCR进行转化子的验证。转化子检测引物序列同1.2.2节。
1.2.4 E. coli ET12567(pUZ8002, pIJ8630-nsdA)与加纳链霉菌ATCC 14672的接合转移
挑取E. coli ET12567(pUZ8002、pIJ8630-nsdA)新鲜单菌落, 接种于5 mL 2× YT液体培养基(含50 μ g· mL-1 Apr、25 μ g· mL-1 Cm、25 μ g· mL-1 Km)中, 37 ℃、200 r· min-1培养过夜, 按1∶ 100的比例转接到含相同抗生素的50 mL 2× YT液体培养基中, 相同条件培养至对数生长期收集菌体, 洗涤2次后悬浮备用。
在加纳链霉菌平板上加入适量2× YT液体培养基, 制备孢子悬液, 振荡充分打散孢子, 过滤, 孢子悬浮液浓度控制在108 cfu· mL-1。50 ℃热激10 min, 37 ℃振荡预培养3 h, 备用。取500 μ L备用的E. coli ET12567菌悬液与500 μ L加纳链霉菌孢子滤液混合, 4 000 r· min-1离心5 min, 弃去大部分上清, 用残留液悬浮菌体后涂布于含10 mmol· L-1 MgCl2的接合转移平板, 于30 ℃培养14 h后用抗生素水溶液(含50 μ g· mL-1Apr、500 μ g· mL-1 NA)洗去大肠埃希菌, 然后取1 mL抗生素水溶液覆盖平板, 30 ℃继续培养2~3 d长出接合子。用接合子数/初始孢子数表示接合转移频率[5]。
1.2.5 接合子的PCR验证
取适量接合子菌丝体到含有50 μ g· mL-1Apr的TSB液体培养基中培养24 h, 收集菌丝体, 提取链霉菌总DNA为模板。根据质粒pIJ8630-nsdA上的Apr抗性基因aac(3)IV来设计引物, 验证阳性接合子。PCR反应程序:95 ℃ 5 min; 95 ℃ 1 min, 58 ℃ 1 min, 72 ℃ 50 s, 30个循环; 72 ℃延伸10 min。引物序列:Apr-F, 5’ -TCTTCGCATCCCGCCTCTGG-3’ ; Apr-R, 5’ -GCAATACGAATGGCGAAAAG-3’ 。
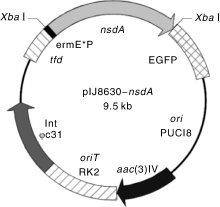
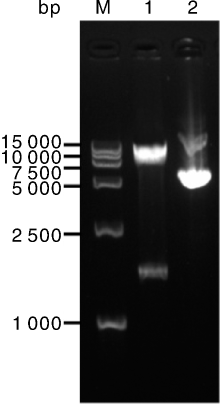
nsdA基因保守存在于多种链霉菌中, 对链霉菌产孢、形态分化, 以及抗生素合成均有负调控作用[8]。为研究接合转移条件, 构建nsdA基因过表达质粒pIJ8630-nsdA, 其图谱见图1。pIJ8630-nsdA的酶切鉴定结果如图2所示, 泳道1表明该质粒经Xba I单酶切, 得到7.9 kb大小的空载片段与1 590 bp的nsdA基因全长条带, 与预期相符。将pIJ8630-nsdA转化到E. coli ET12567(pUZ8002)中, 并利用特异性引物CK-F、CK-R进行PCR验证。将验证正确的转化子E. coli ET12567(pUZ8002, pIJ8630-nsdA)作为接合转移的供体菌。
在以链霉菌孢子为受体的接合转移中, 孢子的数量直接决定着接合频率。将浓度约为108 cfu· mL-1的加纳链霉菌孢子液等量分别均匀地涂布在YMS、2CMY、AS-1、MS、RG、TSB和MM培养基上, 30 ℃培养7 d。加纳链霉菌在YMS、2CMY、AS-1这3种培养基上菌苔厚实且孢子致密, 其中, 在2CMY培养基上孢子量最大; 在MM培养基上菌苔稀薄; 在MS、RG、TSB培养基上菌体生长速度快、菌苔厚实, 但产孢量少。综上, 选定2CMY培养基用于加纳链霉菌产生孢子。
为选择大肠埃希菌-加纳链霉菌接合转移系统的抗性标记、确定合适的抗生素筛选浓度, 考查加纳链霉菌对4种在链霉菌接合转移中常用抗生素的敏感性。结果表明, 该菌对安普霉素、硫链丝菌素、链霉素均非常敏感, 当浓度为12.5 μ g· mL-1时即可完全抑制菌体生长, 而卡那霉素则需在25 μ g· mL-1的浓度下才能抑制加纳链霉菌的生长。确定以安普霉素基因aac(3)IV为筛选标记。
2.4.1 加纳链霉菌接合转移培养基
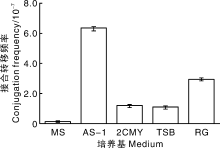
一种适合接合转移的培养基应该同时满足大肠埃希菌和链霉菌生长, 并且使两者生长速度均衡又有利于观察接合子。本研究以加纳链霉菌孢子为受体菌、E. coli ET12567为供体菌, 依据加纳链霉菌在不同培养基上的生长速度, 同时参考其他链霉菌的最适接合培养基, 选择2CMY、MS、AS-1、RG、TSB的固体培养基进行接合转移效果比较。结果显示, 在AS-1、MS、TSB固体培养基上接合子生长良好, 且速度快, 其中, AS-1接合平板的接合频率最高(图3), 所以选择AS-1为大肠埃希菌-加纳链霉菌接合转移培养基。
Mg2+是众多蛋白酶的辅因子, 参与酶活性中心的形成。Choi等[9]研究表明, 增加Mg2+浓度能显著提高接合转移频率。AS-1培养基中含有83 mmol· L-1 MgSO4。试验表明, 在30~150 mmol· L-1范围内MgSO4浓度的改变对接合转移频率没有显著影响。Mg2+除了来源于MgSO4, 还来源于MgCl2。在标准的链霉菌接合转移方法中, MgCl2以10 mmol· L-1的浓度加入接合转移培养基。本试验将AS-1培养基中MgSO4浓度调整为30 mmol· L-1后, 再向其中添加不同浓度的MgCl2(0、10、20、40、50 mmol· L-1)作为接合培养基。结果(图4)表明, 接合转移频率随着MgCl2浓度的提高而提高。将接合转移频率最高的培养基配方命名为WL50。
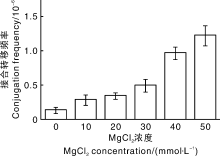 | 图4 接合转移培养基中MgCl2浓度对接合转移频率的影响Fig.4 Effect of MgCl2 concentration in conjugational transfer media on conjugation frequency |
2.4.2 加纳链霉菌孢子预萌发条件
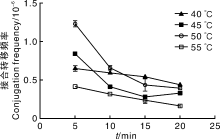
热激处理的目的是为了促进孢子萌发。过高的温度会使孢子存活率降低, 过低的温度又起不到促进孢子萌发的作用。常规的链霉菌接合转移过程中的热激条件为50 ℃、10 min。为了确定加纳链霉菌孢子萌发的最适热激温度和处理时间, 设定40、45、50、55 ℃共4个温度, 每个温度选择5、10、15、20 min 4个时间梯度进行接合试验。结果(图5)表明, 50 ℃、5 min为最佳的加纳链霉菌孢子热激条件。
热激后的预培养处理有助于提高孢子的萌发频率, 从而提高接合频率; 但预培养时间过长会造成芽管萌发过长, 受体聚集成团, 出现多核细胞, 难以获得单菌落, 造成接合转移假阳性率增高。为了研究不同预培养时间对接合转移的影响, 将孢子50 ℃热激10 min后, 进行37 ℃预培养, 以0.5 h为间隔取样镜检。从图6可以看出, 预培养1.5 h时, 由于孢子萌发, 部分孢子体积开始膨大, 细胞内氧化还原酶系开始活跃, 美兰着色变浅, 菌体呈空心圆形。随着预培养时间延长, 体积变大的孢子数占比增大。3.0 h以后, 大部分孢子美兰不着色, 呈现空心状。到3.5 h时, 有少量菌丝出现, 孢子容易被菌丝缠绕而聚集。
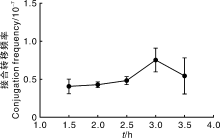
取不同时间预培养的孢子为受体进行接合转移, 结果(图7)显示, 在孢子预培养1.5~3.5 h期间, 接合转移频率差别并不大, 预培养3.0 h频率相对较高。
2.4.3 接合转移体系中供体菌和受体菌的比例
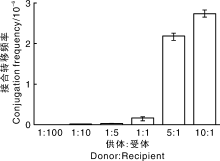
不同链霉菌的生理特性不同, 因此, 在接合转移过程中所需的最适供体菌与受体菌比例存在差异。为了探索大肠埃希菌-加纳链霉菌接合转移体系的最佳供受体比例, 限定受体菌的数量为108, 将供体菌与受体菌细胞数分别以1∶ 100、1∶ 10、1∶ 5、1∶ 1、5∶ 1、10∶ 1的比例混合, 进行接合转移试验。依据图8的结果, 选定10∶ 1作为最佳的供受体比例。
2.4.4 接合转移过程中安普霉素的添加时间
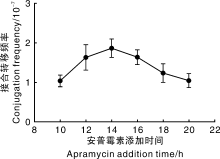
由于链霉菌在接合转移培养基上生长速度存在差异, 因此, 抗生素添加时间对接合转移频率及接合子的有效检出就会产生影响。对加纳链霉菌接合转移过程中安普霉素添加时间进行研究, 结果(图9)显示, 涂板后培养14 h时添加安普霉素效果最佳。
基于单因素试验结果, 选取对大肠埃希菌-加纳链霉菌接合转移频率有较大影响的因素(A, MgCl2浓度; B, 热激时间; C, 供受比), 进行大肠埃希菌-加纳链霉菌接合转移试验, 每因素分别设置3个水平:A1, 30 mmol· L-1, A2, 50 mmol· L-1, A3, 80 mmol· L-1; B1, 5 min, B2, 10 min, B3, 15 min; C1, 5∶ 1, C2, 10∶ 1, C3, 15∶ 1。从正交试验结果(表1)看出, 各因素对接合转移频率的影响为供受比> MgCl2浓度> 热激时间。理论最优水平组合为A2B3C3, 实际最优水平组合为A2B2C3。
| 表1 正交试验结果与数据分析 Table 1 Results and data analysis of orthogonal test |
对正交试验结果进行检验, 结果表明, 实际最优组合A2B2C3与理论最优组合A2B3C3的接合转移频率相近, 与未优化接合转移条件相比, 接合频率提高了20.3倍。
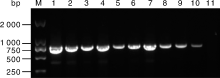
以E. coli ET12567为供体, 加纳链霉菌孢子为受体, 进行接合转移试验。质粒pIJ8630-nsdA含有安普霉素抗性基因aac(3)IV和attP位点, 属于整合型质粒, 可以整合到链霉菌基因组attB位点上, 并随基因组的复制而复制。经安普霉素平板筛选得到抗性菌落, 分离纯化后, 随机挑选9株接合子, 分别提取其总DNA, 使用特异性引物Apr-F、Apr-R扩增aac(3)IV内部744 bp序列。接合转移转化子的PCR验证结果如图10所示, 以pIJ8630-nsdA质粒DNA(阳性对照)和9株接合子DNA为模板, 均能扩增出预期片段(744 bp), 而以出发株加纳链霉菌ATCC 14672总DNA为模板(阴性对照)则没有条带, 说明质粒pIJ8630-nsdA成功接合转移进入加纳链霉菌。
本文通过对接合转移过程中的关键因素进行优化, 建立了一套较高效的大肠埃希菌-加纳链霉菌ATCC 14672接合转移方法, 接合频率提高95.3%。研究发现:1)由于接合转移过程中需要DNA转移酶、细胞壁水解酶等多种蛋白酶作用, 因此, 镁离子可能参与这些酶活性中心的形成[10]。在链霉菌常用培养基中, 只有AS-1培养基中含有大量镁离子, 所以AS-1培养基上接合频率明显较高。2)接合转移频率随供受比增大而提高。这是因为随着供体菌浓度增加, 单位数量的链霉菌所接触到的供体数量增加, 进行接合转移的几率增高, 故接合转移频率增高。供受比为15∶ 1时频率最高, 在今后的试验中, 可尝试提高供受比。3)当热激温度低于50 ℃时, 达不到多数加纳链霉菌孢子萌发的条件, 而高于50 ℃, 会对孢子造成不定程度的损伤。随着热激时间延长, 孢子活力降低, 接合频率随之降低。4)由于群体中各个孢子萌发有先后, 在3.5 h内每个时间段具接合转移最佳状态的孢子所占比例相差不大, 所以预培养时间对接合频率影响不大。5)接合14 h左右, 大肠埃希菌中质粒向加纳链霉菌转移过程基本完成, 此时接合频率最高。小于14 h覆盖抗生素, 阻断了部分菌体间的接合, 导致接合频率降低; 而超过14 h后, 由于生长速度的极大差异, 过量的大肠埃希菌会产生菌膜覆盖在链霉菌表面, 与其争夺氧气与营养, 导致链霉菌生长受到抑制, 接合转移率下降。
加纳链霉菌接合转移体系的建立及优化是对其进行分子遗传操作、构建黄霉素高产菌株, 以及验证一些调控基因和次级代谢产物合成基因功能的必要前提。本研究为获得更优的大肠埃希菌-加纳链霉菌接合条件提供了参考, 同时为实现基因工程菌株的构建, 以提高该菌产生黄霉素的能力奠定了基础。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|