作者简介:吴依婷(1996—),女,福建漳州人,生物工程专业本科生。E-mail: 13159127972@163.com
黄精是重要的药食同源植物。采集湖南洪江市发生的黄精根腐病株,从其分离菌株HF2的培养性状和形态学特征、真菌rDNA内转录区(ITS)、EF-1a区序列分析和系统发育关系比较等方面对该菌株进行了鉴定;通过平板对峙试验筛选对黄精根腐病菌具有抑制作用的内生细菌,并进行形态观察、生理生化指标测定和16S rRNA序列分析。结果表明:从根腐病株中分离得到的菌株为尖孢镰刀菌( Fusarium oxysporum);从黄精中分离获得40株内生细菌,对尖孢镰刀菌有抑制作用的菌株10株,其中A8的抑菌效果最好,对病原菌的抑菌圈半径可达13 mm,经鉴定为枯草芽孢杆菌( Bacillus subtilis)。
Polygonatum sibiricum is a medicinal and food plant in China. The strain HF2, isolated from root rot of Polygonatum sibiricum in Hongjiang City, was classified and identified by morphological characteristics, ribosomal DNA (rDNA) internal transcribed spacer (ITS), EF-1a sequence analysis and its phylogenetic relationships with other species of the genus Fusarium. Bacteria were screened from endophytic resources of P. sibiricum against the strain HF2, and were identified by the characteristics of morphology, 16S rRNA sequence analysis and physiology and biochemistry tests. The results showed the strain HF2 was identified as Fusarium oxysporum. Of 40 endophytic bacterial strains isolated, ten strains exhibited good inhibition activity against F. oxysporum in vitro, and the strain A8 showed the highest antifungal activity with inhibition zone of 13 mm. The strain A8 was identified as Bacillus subtilis.
植物内生菌是指在整个生活史或是生活史的某一阶段可以定殖于宿主植物健康细胞之间或者细胞内, 却不危害宿主的微生物, 是一类未充分开发利用的重要微生物资源[1, 2, 3]。内生菌靠入侵植物组织获取营养, 并得到宿主的保护, 同时产生具有生物活性的代谢产物来提高宿主的抗逆性能。近年来, 生物防治以其安全、高效及无污染等特点成为植物病害防治的重要途径。国内外有关内生细菌的生防作用研究报道最多的是其对植物土传病害的抑制作用。现已从油茶、辣椒、棉花、玉米、油菜、马铃薯等多种作物体内分离筛选到对油茶根腐病、辣椒炭疽病、棉花黄萎病、棉花枯萎病、油菜黄萎病、马铃薯软腐病、马铃薯环腐病等常见真菌和细菌病害具有良好抑制效果的内生细菌[4, 5, 6, 7]。
黄精(Polygonatum sibiricum)为百合科多年生草本植物, 是重要的药食同源植物。2016年, 国家黄精标准化建设项目落户怀化洪江市, 该项目同时也是怀化地区精准扶贫项目。洪江市现有黄精种植面积667 hm2[8]。然而黄精生长期需3 a以上, 常年种植易出现根腐病病害, 严重影响黄精的产量和质量, 甚至导致黄精根茎腐烂绝收。根据多年考察, 我们发现野生黄精不易出现根腐病, 可能是因为野生黄精中具有抑制根腐病的内生菌。目前, 关于黄精根腐病菌鲜有研究报道。本研究从雪峰山区野生黄精中分离出内生细菌, 筛选出对黄精根腐病有明显抑制作用的菌株A8, 并对其进行了鉴定, 以期为黄精根腐病的生物防治提供微生物资源。
1.2.1 黄精内生细菌的分离
用流水清洗健壮的黄精植株块茎表面的泥土残渍, 晾干水分。将黄精块茎放入75%乙醇中处理3 min, 无菌水冲去残留的乙醇; 再置于0.1%升汞溶液中浸泡1 min, 无菌水冲去残留的升汞溶液, 沥去水分。在无菌条件下, 将处理过的块茎磨成匀浆, 用无菌生理盐水稀释10倍后涂布于NA培养基上, 28 ℃培养2~5 d。待培养基上长出可见菌落时, 及时挑取菌落, 在LB培养基平板上多次划线分离, 获得纯培养物。
表面消毒效果的检查:取最后一遍冲洗黄精块茎的无菌水, 涂布于NA培养基上, 37 ℃下培养2 d后无菌落长出, 表明消毒彻底, 样品表面已无附生菌。
1.2.2 黄精根腐病菌株的分离
参考檀国印等[7]报道的方法, 分离黄精根腐病菌株。
1.2.3 平板对峙检测
按宋光桃等[4]的方法, 在PDA平板中央接种直径6 mm的黄精根腐病分离菌菌饼, 在距离菌饼2.5 cm处点种分离的内生细菌, 每皿接1株内生细菌, 重复3次, 以不接内生菌为对照。于25 ℃恒温箱中培养, 当对照中的根腐病分离菌长至培养皿边缘时, 测量内生菌的抑菌圈直径。
1.3.1 内生细菌和根腐菌的形态学鉴定
按照沈萍等[9]的方法, 无菌条件下, 将根腐菌点接于PDA培养基平板上, 于25 ℃培养3~5 d。取一滴乳酸石碳酸棉兰染液滴于载玻片上, 用镊子取培养物少许, 在50%乙醇中浸一下以除去脱落的孢子, 然后将培养物置于载玻片上的染液中, 用大头针小心地将菌丝分开, 加盖玻片, 显微镜下观察根腐菌菌丝体及孢子形态。
将内生细菌培养物置于LB平板培养基上, 28 ℃培养24 h后进行革兰氏染色和芽胞染色, 在显微镜下观察菌体形态、大小、芽胞形状和着生部位; 将内生细菌培养物置于28 ℃培养48 h后观察菌落形态。参照何红等[5]的方法进行菌株的生理生化试验。
1.3.2 根腐病分离菌株的分子生物学鉴定
按照文献[10]报道的方法收集黄精根腐病分离菌的菌丝体并提取其DNA。选用真菌rDNA内转录区(ITS)扩增的通用引物ITS5(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3'), PCR扩增分离菌的ITS区段。反应体系如下: 1 μ L dNTP(2.5 mmol· L-1), 0.2 μ L Taq 酶(5 U· μ L-1), 2.5 μ L 10× PCR缓冲液, 0.5 μ L引物ITS4(10 μ mol· L-1), 0.5 μ L引物ITS5(10 μ mol· L-1), 0.5 μ L(约20 ng· μ L-1)基因组DNA, 加ddH2O至25 μ L。扩增程序为:94 ℃预变性3 min; 94 ℃变性30 s, 53 ℃退火30 s, 72 ℃延伸30 min, 30个循环; 72 ℃延伸6 min, 4 ℃保存。反应完成后, 取PCR产物进行凝胶电泳检测。切胶回收目标条带, 由擎科生物技术(长沙)有限公司完成测序工作。
翻译延伸因子EF-1a序列常用来鉴定镰刀菌属真菌[11], 且EF-1a在物种鉴定方面有高分辨能力, 较以往的ITS序列有较多的种间变异, 适于作为系统进化研究的遗传标记[11, 12]。选用镰刀菌EF-1a扩增的通用引物EF-1(5'-ATGGGTAAGGARGACAAGAC-3')和 EF-2(5'-GGARGTACCAGTSATCATGTT-3')对延伸因子EF-1a区进行扩增。所用引物反应在 25 μ L体系中进行, 各组分如下:1 μ L dNTP(2.5 mmol· L-1), 0.2 μ L Taq酶(5 U· μ L-1), 2.5 μ L 10× PCR缓冲液, 0.5 μ L引物EF-1(10 μ mol· L-1), 0.5 μ L引物EF-2(10 μ mol· L-1), 1.0 μ L(约20 ng· μ L-1)基因组DNA, 加ddH2O至25 μ L。扩增程序为:94 ℃预变性3 min; 94 ℃变性30 s, 51 ℃退火30 s, 72 ℃延伸1 min, 32个循环; 72 ℃延伸6 min, 4 ℃保存。反应完成后, 取PCR产物进行凝胶电泳检测。切胶回收目标条带, 由擎科生物技术(长沙)有限公司完成测序工作。利用Clustal X程序, 将黄精根腐病分离菌的EF-1a序列与GenBank EF-1a序列进行同源性比较, 确定该分离菌的分类地位。最后采用邻位加入法(neighbor-joining, NJ)构建基于EF-1a序列的黄精根腐病分离菌株和同属真菌的系统发育树, 选择Bootstrap method测试法, 1 000次重复, Kimura 2-parameter模型, 其他参数为默认设置。
1.3.3 内生细菌的分子生物学鉴定
对内生细菌的16S rRNA进行PCR扩增, 引物为27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1541R(5'-AAGGAGGTGATCCAGCCGCA-3')。反应体系如下:基因组DNA模板1 μ L, 引物各1 μ L, Taq酶0.25 μ L, dNTP(2.5 mmol· L-1)4 μ L, 10× PCR缓冲液2.5 μ L, MgCl2 4 μ L, 加ddH2O至25 μ L。PCR反应条件:94 ℃预变性3 min; 94 ℃变性30 s, 52 ℃退火1 min, 72 ℃延伸1.5 min, 30个循环; 72 ℃延伸10 min; 4 ℃保存。取PCR产物进行凝胶电泳检测。切胶回收目标条带, 测序工作由擎科生物技术(长沙)有限公司完成。将测序结果与NCBI数据库中微生物16S rDNA序列进行BLAST比对, 以确定菌种分类。
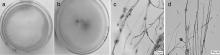
将黄精根腐病菌株中获得的分离菌编号为HF2。HF2菌株在PDA上生长较快, 5 d可长满直径90 mm的培养皿。菌落圆形, 气生菌丝呈白色, 绒状, 茂密, 有分枝, 培养后期菌落背面产生色素, 培养皿背面呈紫黑色(图1-a、b); 分生孢子在气生菌丝分枝的梗上形成, 单孢有隔、卵形, 直或稍弯, 顶端稍尖, 基部钝, 大小(5.7~8.6) μ m× (1.3~1.9) μ m; 厚垣孢子球形, 插生于菌丝体间, 单顶生或串生, 大小(4.8~11.9) μ m× (5.7~12.4) μ m(图1-c、d)。
用引物ITS4和ITS5对HF2的ITS区段进行PCR扩增, 获得长约为579 bp的DNA片段。将比较排列后的序列提交到GenBank中, 获得序列登录号(MH001545), 将该序列与核酸数据库BLAST比对, 显示该菌株与GenBank中已登录的尖孢镰刀菌(F. oxysporum)序列的同源性为99%, 从而在分子水平上证明分离获得的菌株为Fusarium sp.。为了进一步鉴定该分离菌, 对其EF-1a延伸因子的基因序列进行分析, 片段大小为685 bp, 提交到GenBank中, 获得序列登录号(MH006685), 其序列与GenBank数据库中其他F. oxysporum 的EF-1a延伸因子序列相似性为100%(图2)。
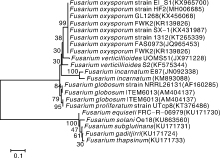 | 图2 NJ法构建的基于EF-1a序列的HF2菌株和其他镰刀菌的系统发育树Fig.2 Phylogenetic dendrogram of isolate HF2 and other isolates of Fusarium spp. constructed by using neighbor-joining (NJ) method based on EF-1a sequences |
从系统进化树可以看出, 系统发育树可分为两个主要分支。第一支又分为两大类群, 其中一类由本种HF2菌株、Fusarium oxysporum、F. verticillioides、F. incarnatum构成; 另一类由F.globosum、F. proliferatum构成。第二支由F. equiseti、F. solani、F. subglutinans、F. gaditjirri、F. thapsinum构成。本种与已报道的F. oxysporum以99%的相似度聚类在一起, 而Fusarium属的F. equiseti、F. solani、F. subglutinans、F. gaditjirri、F. thapsinum则以较远的亲缘关系处于系统发育树的外围。
从健壮野生黄精中筛选获得了40株内生细菌, 以黄精根腐病分离菌HF2为目标菌, 用对峙生长法测试了这40株内生细菌对HF2的抑制作用。结果显示, A3、A6、A7、A8、A11、A12、A17、B8、C5和C8这10株内生细菌对HF2具有较强的抑制作用, 其中抑菌圈大于 10 mm的有 4株, 分别为A6、A8、A11、A17(表1)。这10株菌株多为乳白色, 菌落不透明, 边缘不整齐。不同菌株对HF2的抑菌效果不同, 除A12、B8、C8无显著差异外, 其他各菌株均存在显著差异, 其中菌株A8的抑菌效果最好。
| 表1 内生细菌在NA培养基上的菌落特征及抑菌效果 Table 1 Colony characteristics of antagonistic endophytic bacteria on the NA medium and their bacteriostatic effect |
在LB琼脂平板上, A8菌落表面粗糙不规则, 边缘扩散状, 不透明, 污白色, 易挑起, 不分泌色素, 见图3-a。培养24 h的菌体呈柱状, 大小为1.1 μ m× 3.2 μ m, 革兰氏染色为阳性, 芽孢中生, 椭圆形, 见图3-b。淀粉水解试验、葡萄糖发酵试验、接触酶试验、明胶液化试验和油脂水解试验都为阳性, 甲基红反应和乙酰甲基甲醇试验(V.P.试验)为阴性, 初步鉴定该菌株为芽孢杆菌Bacillus sp.。
平板对峙实验如图3-c所示, A8对黄精根腐分离菌(F. oxysporum)HF2的生长有明显抑制作用, 可以产生明显的抑菌带, A8菌落边缘的HF2菌丝生长缓慢, 正常生长的HF2菌丝呈圆形扩展。
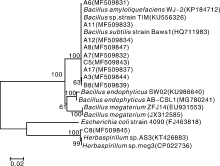
对10株内生细菌(A3、A6、A7、A8、A11、A12、A17、B8、C5和C8)的16S rRNA序列进行PCR扩增, 序列经过Clustal X比较排列后, 提交到GenBank中, 获得序列登录号分别为MF509844、MF509831、MF509832、MF509847、MF509833、MF509834、MF509837、MF509839、MF509843、MF509845。将该序列与核酸数据库BLAST比对, 显示A6、A11、A12、A8、A7、C5、A17、A3、B8菌株与Bacillus sp.多个菌株的序列相似性均为99%, 确定这些菌株为Bacillus sp.。C8与Herbaspirillum sp.多个菌株的序列相似性为98%, 确定该菌为草螺菌属(Herbaspirillum sp.)。其中对黄精根腐病菌具有高抑菌活性的内生菌株A8, 综合其菌落形态特征、染色结果和16S rDNA序列比对分析结果, 确定该菌株为Bacillus subtilis。
镰刀菌能引起作物发生病害的报道近年来逐渐增多, 但未见引起黄精根腐病的报道。本研究首次研究了黄精根腐病, 发现湖南洪江黄精根腐病的主要分离菌为尖孢镰刀菌(F. oxysporum), 该菌常引发作物根腐病害[7, 11, 12]。F. oxysporum是一类形态比较特殊的镰刀菌, 本试验采用ITS联合EF-1a序列的分子鉴定, 再结合显微形态观察, 达到鉴定的目的, 为进一步研究黄精镰刀菌根腐病的防治提供了依据。
已有研究表明, 植物内生菌的防病作用机制主要有4种:(1)通过分泌抗菌活性物质, 如脂多肽、硝砒咯菌素、丁酰内酯、吩嗪羧酸等产生拮抗作用[13, 14, 15, 16], 或者产生一些水解酶类, 如几丁质酶和葡聚糖酶等, 酶解病原菌的细胞壁或降解其他致病因子如毒素等, 从而抑制病原菌生长[17, 18]; (2)占据空间位点和营养竞争, 内生细菌在植物组织中繁衍和定殖, 优先占领植物体内有限的生存位点, 可以有效地阻止病原微生物的侵染, 达到抑菌效果[19, 20]; (3)在植物受到病菌侵袭时, 定殖于植物体内的内生细菌能够诱导植物产生系统抗性, 而且不会对寄主植物产生不良影响[21, 22]; (4)通过促进植物生长, 增强植物的抗逆能力, 从而间接提高植物的抗病性[23, 24]。植物内生细菌具有丰富的多样性, 包括革兰氏阳性和阴性菌共计54个属129个种, 其中芽孢杆菌最为常见[25]。由于芽孢杆菌具有繁殖速度快、营养简单、抗逆性强、能产生多种抑菌物质、易在植物体内定殖和不污染环境等突出特性, 已成为一种理想的微生态制剂菌种, 广泛用于防治植物病害, 可有效减少或替代化学农药在植物种植过程中的使用。草螺菌常见于禾谷类植物和双子叶植物茎或根部, 多数草螺菌具有固氮或产生植物激素的功能并具有使宿主植物增产的潜能。本研究筛选出10株对黄精根腐病分离菌具有较强抑制作用的黄精内生细菌, 其中, A6、A11、A12、A8、A7、C5、A17、A3、B8菌株为Bacillus sp., 内生菌株A8对黄精根腐病菌株具有较高的抗菌活性, 经鉴定为枯草芽孢杆菌(Bacillus subtilis), 但菌株A8的林间防治效果及其对黄精根腐病菌的防病作用机制还有待进一步研究。C8为Herbaspirillum sp., 其所属类群还有待于进一步鉴定, 是否具有固氮或促进植物生长的功能还有待研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|