作者简介:雷雪平(1993—),女,四川绵阳人,硕士,研究方向为水生动物病原学与病理学。E-mail: leixpingsicau @163.com
2016年4月四川雅安一棘胸蛙( Quasipaa spinosa)养殖场暴发一种临床特征表现为白内障、体表溃疡和神经症状的传染病。为明确此次流行病病因,本研究进行了病原菌分离、人工感染、分离菌理化特性与16S rDNA基因序列分析。结果从患病蛙肝、脾、肾中分离到一株G-短杆菌(CM160701);将其腹腔注射感染健康棘胸蛙表现出与自然发病蛙相似症状。该菌的LD50为1.19×106 cfu·只-1;通过理化特性与16S rDNA基因序列分析鉴定分离菌为脑膜炎败血伊丽莎白菌( Elizabethkingia meningoseptica);其对氟苯尼考敏感,对恩诺沙星、多西环素、阿莫西林等多种药物耐受。病理组织学观察发现,其感染对全身多组织器官造成损伤,表现出明显的变性、坏死和炎症反应,尤以脑、肝、脾、心和肾损伤严重。该研究证实了脑膜炎败血伊丽莎白菌是本次疫情的病因,其感染引起棘胸蛙全身性损伤导致多组织器官功能障碍而死亡。
In April 2016, a serious infectious disease characterized by cataract, cutaneous ulcer and neurological symptoms emerged in a Quasipaa spinosa farm in Ya'an, Sichuan Province. In order to explore the etiology, the pathogen isolation, artificial infection, physical and chemical characteristics of isolated bacteria and sequence analysis of 16S rDNA gene were analyzed. The results showed that a Gram-negative, short rod-shaped bacillus (CM160701) was isolated from the diseased frogs. Healthy Chinese spiny frogs injected the isolate intraperitoneally exhibited the similar clinical signs, gross and histopathological lesions to the naturally infected frogs, and the LD50 value of the isolate was 1.19×106 cfu per frog. The isolated strain was identified to be Elizabethkingia meningoseptica according to physicochemical properties and the 16S rDNA gene sequence analysis. The strain was sensitive to florfenicol, but resistant to enrofloxacin, amoxicillin, doxycycline and so on. Histopathological observation found that the E. meningoseptica infection in Quasipaa spinosa could cause pathological damages to multiple organs which showed degeneration, necrosis and inflammation significantly, especially in the brain, liver, spleen, heart and kidney. This study confirmed E. meningoseptica was the pathogen of the epidemic, and the E. meningoseptica infection could cause Quasipaa spinosa multi-system injuries and lead to death.
脑膜炎败血伊丽莎白菌(Elizabethkingia meningoseptica), 曾称脑膜炎脓毒黄杆菌(Flavobacterium meningosepticum)或脑膜炎败血金黄杆菌(Chryseobacterium meningosepticum), 是一种广泛分布于自然界和医院环境的G-杆菌[1, 2]。该菌是一种重要的人与动物共患条件致病菌, 在人类可引起腹膜炎、肺炎、脑膜炎、蜂窝组织炎、败血症和眼部感染等, 同时也可以感染禽类、猫、犬和鱼类等动物, 其感染的宿主范围在不断扩大[3, 4, 5, 6], 给人类与动物健康均造成严重威胁。
棘胸蛙(Quasipaa spinosa), 俗称石蛙、石鸡等, 属蛙科、棘蛙属, 其栖息地主要分布在中国南部和越南北部[7, 8]。棘胸蛙肉质细嫩, 味道甘美, 同时具有很高的药用价值, 由于人为捕捉和栖息地范围的缩小, 野生棘胸蛙种群数量急速减少, 已被中国物种红色名录列为易危等级, 并于2004年被世界自然保护联盟(IUCN)评估为全球性易危种[9, 10]。为了保护和利用棘胸蛙, 其养殖业逐渐在全国各地兴起并形成了一定的规模, 但随着养殖规模的扩大, 病害问题日益突出。2016年4月在四川雅安某棘胸蛙养殖场流行一种以白内障、体表出血溃疡及神经症状为特征的高发病率和死亡率的传染病。本研究从患病蛙体内分离出一株G-短杆菌(CM160701)并鉴定其为脑膜炎败血伊丽莎白菌(E. meningoseptica), 同时进行了药敏试验、人工感染试验和病理损伤观察, 以期为棘胸蛙养殖中该疾病的诊断与防治提供参考。
患病棘胸蛙采自四川雅安某养殖场, 体质量145.3~162.0 g; 健康棘胸蛙体质量134.2~150.7 g, 采自雅安天全某养殖场。脑心浸液培养基(BHI)(北京欣经科生物技术有限公司); MH 培养基(杭州微生物试剂有限公司); 细菌DNA 提取试剂盒 [天根生化科技(北京)有限公司]; 药敏纸片(杭州天和微生物试剂有限公司); 细菌生化微量鉴定管(杭州微生物试剂有限公司)。
对患病棘胸蛙进行剖检, 取肝、脾、肾等组织于载玻片涂片, 革兰氏染色并观察。在无菌条件下, 从病蛙的肝、脾、肾取样划线接种于BHIA, 28 ℃恒温培养24~48 h, 挑取形态大小一致的优势菌落于BHIA进一步纯化, 获得纯培养菌株, 观察菌落及细菌形态特征, -80 ℃保存备用。
将获得的优势纯化菌株接种于BHI 平板, 28 ℃恒温培养24 h, 用0.8%无菌生理盐水洗下, 麦氏比浊法将细菌浓度调整为1.0× 105、1.0× 106、1.0× 107、1.0× 108 cfu· mL-1。健康棘胸蛙室内暂养7 d后, 每只腹腔注射0.2 mL, 每组10只, 对照组注射等量生理盐水。接种后每天观察棘胸蛙的临床症状和死亡情况, 连续观察14 d, 并对死亡蛙及时剖检和病原菌再次分离与鉴定。
生理生化试验根据《伯杰氏系统细菌学手册》对细菌进行初步鉴定。药敏试验参照CLSI抗微生物药物敏感性实验执行标准, 采用Kriby-Bauer纸片扩散法进行。将分离菌接种BHI 液体培养基, 28 ℃ 震荡培养 24 h, 调整菌液浓度为1.0× 108 cfu· mL-1, 将菌液均匀涂布MH平板, 贴上药敏纸片, 28 ℃培养24 h, 测量抑菌圈大小, 根据相应标准判定结果, 同时以大肠埃希氏菌ATCC25922作为质控菌株。
使用细菌DNA提取试剂盒抽提新鲜菌液的DNA作为模板。采用扩增16S rDNA基因的通用引物 (F:5'-AGAGTTTGATCCTGGCTCAG-3'; R:5'-TACG GCTACCTTGTTACGAC -3')[11]扩增预期1 500 bp大小的16S rDNA基因片段。PCR反应体系及反应条件参照余泽辉等[12]的方法进行。PCR产物经DNA纯化试剂盒纯化后, 送成都擎科梓熙生物技术有限公司测序。测序结果与GenBank 中已知核酸序列进行BLAST分析, 采用DNA star软件的Seqman程序进行多序列比对, MEGA6.0构建系统发育树。
取患病棘胸蛙的心、肝、脾、肺、肾、肌肉等组织, 10%中性福尔马林缓冲液固定, 石蜡包埋切片, HE染色, 中性树脂胶封片, 光学显微镜观察病理变化并照相。
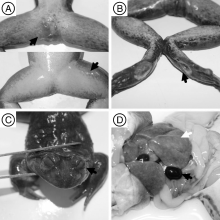
患病棘胸蛙食欲减退或丧失, 体表发黑, 头颈歪斜, 身体失去平衡, 在水中间歇性游动打转; 腹部膨胀, 四肢肿大, 脚趾蜷曲, 腿部肌肉出血(图1-A); 部分棘胸蛙的皮肤可见溃疡灶(图1-B), 眼球角膜发白, 浑浊呈“ 白内障” 表现(图1-C)。从发病到死亡时间一般为2~4 d。剖检见病蛙腹腔有一定量淡黄色, 透明腹水, 肝脏肿大, 瘀血, 呈花斑状(图1-D); 脾肿大, 呈紫黑色; 脑膜充血, 神经症状严重的病例见脑软化; 部分病蛙肠壁变薄呈半透明状, 其内充满透明黏液。
病蛙内脏组织涂片, 革兰氏染色镜检发现组织内有G-短杆菌。无菌操作从病蛙肝、脾和肾内分离到一株优势菌(CM160701), 其在BHI平板上的菌落形态为表面光滑湿润、边缘整齐、不透明的淡黄色小菌落, 直径为0.78~0.96 mm。革兰氏染色镜检为G-, 呈短直杆状, 菌体约长2~3 μ m, 单个排列。
分离菌腹腔注射感染健康棘胸蛙, 攻毒12 h后, 试验蛙安静反应迟钝; 1.0× 108 cfu· mL-1浓度组在24 h后开始出现死亡, 1.0× 107、1.0× 106与1.0× 105 cfu· mL-1浓度组相继在32 h后开始死亡; 发病蛙的临床表现和病理变化与自然发病蛙相似, 感染5 d后各试验组蛙未再发生死亡; 而对照组无任何异常, 各组的死亡情况见表1。采用寇氏法得出分离菌对棘胸蛙的LD50为1.19× 106 cfu· 只-1。从人工感染发病死亡的棘胸蛙体内再次分离细菌, 获得与感染接种菌形态、理化特性与16S rDNA基因序列一致的菌株。
| 表1 菌株CM160701人工感染试验结果 Table 1 Artificial infection results of the strain CM160701 |
分离菌株的生理生化特性见表2, 其与脑膜炎败血伊丽莎白菌生理生化特性基本一致。药敏试验结果显示, 该分离株仅对氟苯尼考敏感, 对阿莫西林、氨苄西林、头孢唑林、氧氟沙星、环丙沙星、恩诺沙星、四环素、多西环素、丁胺卡那、链霉素、庆大霉素、红霉素、阿奇霉素、复方新诺明与林可霉素耐药, 具有强耐药性。
| 表2 分离株CM160701生理生化特性 Table 2 Comparison of phenotypic characteristics of strain CM160701 and E. meningoseptica |
以分离菌株的DNA为模板, 扩增的16S rDNA基因条带与预期相符(GenBank 获得登录号为KY930330), 测序后在GenBank进行BLAST分析, 结果显示分离菌与GenBank上E. meningoseptica的同源性最高, 达100%; 基于分离菌的16S rDNA 基因序列及GenBank 中黄杆菌属其他细菌16S rDNA 序列构建的系统发育树上, 分离菌与E. meningoseptica聚为一支(图2)。
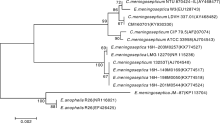 | 图2 基于16S rDNA基因序列构建的分离菌 CM160701与相关菌株的系统发育树Fig.2 Phylogenetic tree of CM160701 and related strains based on 16S rDNA sequences |
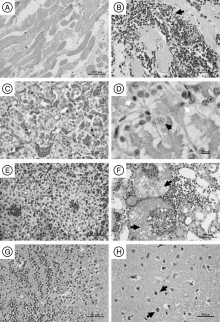
患病蛙骨骼肌纤维变性, 呈波浪状, 横纹消失, 胞质红染均质无结构, 严重者断裂或溶解, 呈条索状或团块状(图3-A)。心肌纤维肿胀, 横纹消失, 颗粒变性、空泡变性, 甚至坏死, 肌间隙出血、大量炎症细胞浸润(图3-B)。肝血窦扩张, 淤血, 肝细胞肿胀, 广泛性空泡变性(图3-C), 并在肝小叶内见肝细胞核浓缩、溶解, 细胞崩解形成的灶性坏死及细菌团块(图3-D)。脾髓内淋巴细胞数量显著减少, 白髓体积缩小甚至消失, 红髓淤血、出血, 网状细胞大量增生(图3-E)。肾小球血管内皮细胞和系膜细胞大量增生, 血管球充血, 肾小囊内充满均质红染蛋白样渗出物(图3-F), 肾小管上皮细胞颗粒变性与空泡变性, 局部区域肾小管上皮细胞坏死脱落, 肾小管管腔内大量蛋白或脱落的上皮细胞形成管型, 肾间质局灶性出血, 炎症细胞浸润。脑膜疏松, 毛细血管淤血, 脑基质内小胶质细胞大量增生(图3-G), 神经元细胞核固缩, 染色加深, 增生的小胶质细胞围绕在其周围形成“ 卫星” 现象或呈“ 噬神经元” 现象(图3-H)。
脑膜炎败血伊丽莎白菌(E. meningoseptica)作为一种人与动物共患的病原菌不仅对人类健康造成威胁, 也对禽、猫与犬等多种动物造成严重危害。现有研究发现, 该菌可感染爪蟾(Xenopus laevis)[13, 14]、美国牛蛙(Rana catesbeiana)[15, 16]、豹蛙(Rana pipiens)[17]、虎纹蛙(Rana tigerina rugulosa)[18]等蛙类并引起大量死亡; 本研究表明, E. meningoseptica对健康棘胸蛙具有较强的致病性, 且可自然感染棘胸蛙并造成大量死亡, 由此可见, E. meningoseptica可能是蛙类的一种重要病原, 对蛙类健康造成严重威胁。近几十年来, 全球范围内蛙类等两栖动物种群数量快速下降, 已有研究表明, 蛙病毒(ranavirus)病、壶菌病(chytridiomycosis)等传染性疾病在两栖动物种群数量下降中有重要作用。鉴于E. meningoseptica对蛙类危害的严重性, 其是否会是又一威胁其种群数量的病原值得人们关注[19, 20]。
在本研究中, 患病棘胸蛙临床特征主要表现为食欲减退、行动迟缓、白内障、皮肤出血溃疡、四肢肿胀和神经症状等, 与先前报道的美国牛蛙与虎纹蛙等感染E. meningoseptica相似[15, 18], 其中白内障与神经症状具有代表性, 可以作为临床上诊断该病的一个重要参考依据。组织病理研究发现, E. meningoseptica感染棘胸蛙可导致全身多器官组织损伤, 尤其是脑、心、肝、脾与肾等组织损伤严重, 表现为明显的变性、坏死和炎症反应, 致多组织器官功能障碍而引起感染蛙的死亡。感染蛙脑神经元表现为明显的变性、坏死, 小胶质细胞大量增生, 出现“ 卫星” 现象或“ 噬神经元” 现象, 这应当是临床上感染蛙出现神经症状的病变基础, 但对于E. meningoseptica是如何突破血脑屏障对脑导致损伤的机制还需要进一步的研究; 同时研究中也发现免疫器官脾脏的淋巴细胞数量显著减少, 网状细胞大量增生, 表明该菌对蛙的免疫系统也有明显的损伤, 对于其损伤的发生机制值得进一步探索。
由于E. meningoseptica可产生包括金属类β -内酰胺酶和超广谱β -内酰胺酶在内的多种β -内酰胺酶, 常具有多重耐药性, 尤其对碳青霉烯类抗生素、头孢类抗生素耐药更明显[21, 22]。研究发现, 该E. meningoseptica分离株对测试的大多数抗生素表现出耐药性, 仅对氟苯尼考敏感, 在实际处理中推荐使用氟苯尼考成功控制了疫情。药敏试验结果与李明等[23]分离的E. meningoseptica在药物敏感上有较大差异, 表明在不同时间不同地域的分离株耐药表型可能不同, 提示在临床上应根据药敏试验结果选择用药, 提高用药的有效性。但由于抗生素的使用易导致新耐药菌株的产生以及环境污染, 因此, 针对蛙类E. meningoseptica感染的防控, 应在研究疫苗、免疫增强剂及中草药制剂等方面积极开展探索, 以减少抗生素的使用; 同时, 在如彻底的消毒、水质调整、降低养殖密度和减少应激等养殖环境控制与饲养管理上也应进行相应的改善工作以降低该病的发生风险。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|