作者简介:戴超辉(1993—),女,湖南新化人,博士研究生,研究方向为猪抗病育种。E-mail:chdai1993@163.com
Toll样受体(toll like receptors, TLRs)作为模式识别受体,不仅能够对机体特异性配体进行识别,并通过多种信号传导通路(由髓样分化蛋白88或由β-干扰素TLR结构域衔接蛋白介导)启动信号传导继而引发特异性的免疫应答,同时还在一些由支原体、病毒、细菌等感染引起的免疫应答过程中发挥了重要的调控功能。因为其重要的免疫调控作用,Toll样受体家族已成为近些年研究的热点,对畜禽抗病育种工作也具有重要的科学意义和应用前景。文章综述了猪源TLRs的种类、功能、遗传变异以及介导的信号通路,并重点介绍了猪源TLRs在抗病育种中的应用,旨在为猪Toll样受体家族基因功能研究及有效遗传标记的筛选提供参考依据。
Toll-like receptors (TLRs), as pattern recognition receptors, can not only recognize body's specific ligands and start signal transduction through a variety of signaling pathways (mediated by myeloid differentiation protein 88 or by the TLR domain protein of beta-interferon), which leads to specific immune responses, but also play important regulatory roles in some immune responses caused by mycoplasma, viruses, bacteria and other pathogens. Toll-like receptor family has become research hotspots in recent years because of its important immune regulations, which has important scientific significance and application prospect for the breeding of livestock and poultry. The types, functions, heritable variation and mediated signaling pathways of pig Toll-like receptor family were reviewed in this article, and the application of pig TLRs in disease resistance breeding was introduced intensively, which aimed to provide reference and basis for the research of gene function of pig Toll-like receptor family and screening effective genetic markers.
猪病频发是当前规模化养猪业面临的严峻问题, 给养猪产业带来了严重的经济损失, 而抗生素和药物等的滥用又引发了一系列如环保、抗生素残留、食品安全等问题。虽然现在养殖场的管理水平和疾病防治技术不断完善和提高, 在一定程度上减少了疾病的发生和传播, 但并未从根本上彻底防控猪病的发生。因此, 发掘与抗病性状有关的分子标记, 通过分子选育从遗传本质上提高猪群的一般抗病力和特殊抗病力, 是从长远角度解决猪病发生的有效手段之一。猪的抗病性状多表现为中遗传力或低遗传力, 通过传统的育种方法难以对猪的抗病力实施有效的遗传改良, 所以, 抗病育种可以通过间接方法即对抗病力性状(免疫指标或免疫性状)进行选择[1]。免疫力和抗病力有很密切的关系, 因此可以通过增强机体的一般免疫力来间接提高机体的抗病能力。Toll样受体(Toll like receptors, TLRs)最早被发现在果蝇的Toll蛋白, 它不仅可以参与调节胚胎果蝇背腹侧极性的形成, 而且还直接介导果蝇微生物感染的天然免疫反应[2]。在哺乳动物中, Toll样受体基因家族属于I型跨膜蛋白受体, 并广泛分布在胃肠道和呼吸道等组织中, 在机体固有免疫和诱导的适应性免疫, 特别是先天免疫活化的防御机制中起到重要作用[3]。近些年来, 猪Toll样受体(TLRs)已经被广泛研究, 并且它们在先天免疫中的巨大重要性目前正在被揭示; 同时猪是重要的模式动物, 其具有TLR的主要的树突细胞群体与人类是相似的, 对猪源TLRs的研究也将为人类疾病研究和疫苗的开发提供了有效的模型和手段, 具有重要的科学意义和应用前景。为此, 本文主要综述了国内外对猪源TLRs的种类、功能、介导的信号通路以及在猪抗病育种中应用的相关研究进展, 旨在为进一步探讨TLRs对猪免疫调控作用的机制研究提供理论参考。
在人类中已经发现了13种TLR蛋白; 在猪中, 已经克隆并鉴定了TLR1-10这10种TLR蛋白, 在猪中已经鉴定的10个TLR基因具体信息见表1。
| 表1 猪Toll样受体基本信息 Table 1 Pig Toll-like receptor information |
猪TLR1基因定位于8号染色体上, 它的开放阅读框(open reading frame, ORF)长2 391 bp, 并编码796个氨基酸[4]。猪TLR2基因的ORF长2 358 bp, 编码785个氨基酸, 其氨基酸序列与人的同源性为72.3%, 与鼠的同源性为61.0%; TLR2胞外区有4个富含亮氨酸的重复单位(leucine-rich repeat, LRR), 膜外区含6个N连接的糖基化位点, 膜外区蛋白是弯曲状的螺旋结构, 由背侧的α 螺旋和内侧的β 折叠平行交替排列形成, 它的N末端有信号肽[4, 6]。猪TLR3基因的ORF长2 718 bp, 编码906个氨基酸, 为跨膜蛋白, 氨基酸序列与哺乳动物的同源性较高, 其次是鸡, 而与斑马鱼的同源性较低[7, 8, 9]。另外, 管齐赛等[10]克隆的TLR3剪接体基因pTLR3a和pTLR3b由第3外显子部分或全部缺失组成, 使得其缺失部分蛋白质的编码框发生改变, 导致TLR3蛋白二级结构发生了较大的变化。TLR4基因ORF长2 526 bp, 编码了785个氨基酸残基, 其胞外区包含13个LRR, 膜外区有8个糖基化位点, 膜外区蛋白是弯曲状的螺旋结构, 由背侧的α 螺旋和内侧的β 折叠平行交替排列形成, 它的N末端存在信号肽[11, 12, 13]。杨秀芹等[14]克隆的野猪TLR4基因也是由胞外区、跨膜区和胞内区3部分组成, 在多肽链上依次排列着信号肽和LRRs等结构功能域。TLR5基因ORF长2 571 bp, 由642个氨基酸组成的胞外区、23个氨基酸组成的跨膜区和191个氨基酸组成的胞内区组成; 胞外区具有LRR结构域, 胞内区具有TIR结构域(Toll/Interleukin-1 receptor domain), 表现出典型的TLR家族结构特征[14, 15, 16, 17, 18]。TLR6基因和TLR1基因一样, 定位于8号染色体上, 它的开放阅读框(ORF)长2 391 bp, 并编码796个氨基酸, 总氨基酸序列和TLR1具有71%的相似性, 特别是在细胞质区域高达92%, 这与在人TLR1和TLR6之间的高度相似性是一致的, 表明TLR1和TLR6具有高度同源性[5]。猪TLR7基因ORF长3 150 bp, 编码1 050个氨基酸残基, 在进化过程中具有高度保守性, 亲缘关系越近, 同源性越高, 与牛和绵羊的同源性较高, 与马、狗、人、家鼠、褐鼠的次之; 其胞外区包含LRR-RI结构域, 胞内包含TIR结构域, 也是TLR家族典型的结构特征[8, 19, 20, 21, 22, 23, 24, 25]。
猪TLR8基因的ORF长3 087 bp, 编码1 029个氨基酸。同源性分析结果显示, 与牛、马、羊和人的同源性较高, 与鼠的同源性次之, 与鸡的同源性最低, 其蛋白分子结构预测表明猪TLR8为跨膜蛋白[8, 26]。猪TLR9基因ORF长3 093 bp, 编码1 030个氨基酸残基, 包含24个氨基酸构成的信号肽序列, 属于I型跨膜受体, 具有LRR结构域和TIR结构域; 与牛、马、羊和人的同源性较高, 与家鼠、褐鼠的次之[27, 28, 29]。猪TLR10基因ORF长2 862 bp, 编码811个氨基酸, 猪TLR10和人TLR10的氨基酸序列有80%的相似性[4]。因此, 在整个TLRs家族中, TLRs在进化过程中具有高度保守性, 它们的分子结构与其分子功能相适应, 在机体中扮演着不同却重要的角色。
Bergman等[30]对野猪和家猪(汉普夏、长白和大白)的TLR1、TLR2和TLR6基因的开放阅读框进行了测序, 在TLR1、TLR2和TLR6中分别检测到20, 27和26个SNPs; 并且这3个基因在野猪中的SNP频率要相对低于家猪。Shinkai等[15]研究发现在来自11个品种的96头猪的和TLR1、TLR2、TLR4、TLR5和TLR6基因的编码序列中分别包含了21、11、7、13和11个引起氨基酸取代的SNPs。在Muneta等[31]的研究中, 分析了7个不同品种猪的TLR2的单核苷酸多态性(C406G)的基因分型, 结果发现C406G突变仅在日本的长白猪品种中发现。刘胜贵等[32]发现猪TLR2基因多态性程度低, 仅在编码区第1 255位点上存在1个单碱基突变位点, 并且该位点为异义突变。在陈月婵等[33]的研究中, 猪TLR3基因存在3个核苷酸的差异, 分别是c.36C> T、c.2643T> C和c.2649A> G, 且均为同义突变。李海涛等[34]在野猪、民猪、杜洛克、长白猪和大白猪的TLR3基因中检测出了8个SNPs, 并且各种基因型在不同猪品种中的分布存在着明显的差异。邢明伟[35]等分析了猪TLR3基因A1116T点突变的功能, 并在细胞水平上初步确定了该点突变对TLR3的配体识别、信号转导能力具有一定影响。Palermo等[36]的研究发现猪TLR4基因存在34个SNP, 17个在编码区, 17个在非编码区, 5个非同义突变聚集在外显子3上。潘章源等[37, 38]在猪TLR4基因外显子1中分离检测到3个等位基因, 6种基因型, 且TLR4基因外显子1的多态性在中国地方猪品种和引进品种中的分布存在极显著的差异。刘筱等[39]在中国地方猪品种(梅山猪、二花脸、苏钟猪、姜曲海猪、金华猪和淮猪)、引进品种(大约克和皮特兰)等9个群体的TLR4编码区检测到C1027A 突变可引起编码氨基酸性质的改变。朱卫华等[40]也在霍寿黑猪和长白猪的TLR4基因第3外显子检测到了1个错义突变C1027A, 并且该多态位点基因型在霍寿黑猪和长白猪2个中外猪品种间的分布存在极显著差异。丁月云等[41]对安徽地方猪皖南黑猪、圩猪、安庆六白猪、霍寿黑猪及引进品种长白猪共5个群体354个样本的TLR4基因外显子3部分片段的遗传变异进行了检测, 发现G417A、C1027A的各基因型在5个中外猪品种间的分布存在极显著差异。周波等[42]在所检测的5个品种(梅山猪、新淮猪、大白猪、长白猪和杜洛克猪)TLR4基因的SNP中发现了2个能引起编码的氨基酸性质发生改变。陈月婵等[43]对北京黑猪、长白猪、野猪、杜洛克猪、大白猪、民猪6个中外猪品种TLR4基因第3外显子1 824位点的G / A和3'UTR的208位点T / C多态进行群体遗传学分析, 发现它们各基因型在不同猪品种间的分布均存在显著或极显著差异。Ju等[44]克隆了巴马香猪TLR4基因的选择性剪接变体, 发现TLR4基因的第2外显子存在167 bp的短剪接体, 并且该蛋白被推定为一种截短的膜蛋白, 由缺乏信号肽的膜外区、跨膜区和膜内区组成。杨秀芹等[45]比较分析了抗病性差异明显的民猪和长白猪的TLR5基因的变异情况, 结果发现TLR5基因c. 834 T> G点突变在这2个品种间的分布具有极显著差异, 民猪以G为优势等位基因, 长白猪以T为优势等位基因。魏麟等[46]发现猪TLR6基因片段MspI酶切位点具有两种等位基因T / C, 并且C等位基因是群体中的优势等位基因。Bergman[47]发现TLR1和TLR2基因在家猪中比在野猪中存在更多的SNPs。Clop等[48]对10个猪品种的10个TLR基因进行了基因分型研究, 最终鉴定了306个SNPs, 其中147个变异位点能够引起氨基酸的改变。猪10种TLRs的CDS区中多态性的分布情况见表2。
| 表2 猪模式识别受体PRRs的CDS区中多态性的分布 Table 2 Distribution of polymorphisms in CDS of porcine pattern recognition receptors (PRRs) |
在整体上, TLRs家族虽然高度保守, 但仍具有一定的遗传变异多样性, 尤其是一些非同义突变可能对蛋白结构甚至对基因功能产生影响。并且在不同猪品种中, TLRs的遗传变异也具有一定的差异性, 这跟不同猪品种的抗逆性或抗病性也是有一定联系的, 例如抵抗力相对较高的野猪、藏猪、民猪、梅山猪等猪品种中, TLRs的多态性普遍偏低。因此, 筛查显著影响表型的变异位点将对猪的抗病育种具有重要的意义。
Uddin等[50]的研究发现猪TLR家族(TLR1-10)基因在所检测的肠相关淋巴组织(胃粘膜、十二指肠, 空肠和回肠和肠系膜淋巴结)中都有mRNA表达, 并且TLR3在TLRs中显示出最高的mRNA丰度; 成年猪肠系膜淋巴结中的TLR1和TLR6的表达量高于新生猪; TLR2、TLR3和TLR9的蛋白质定位显示TLR表达在细胞固有层中, 并且在肠中的淋巴集结以及在肠系膜淋巴结中的淋巴滤泡周围和内部丰度较高。Marantidis等[51]发现, 所有检测的TLRs基因都在雄性和雌性猪的生殖器官中表达, 其中TLR3和TLR5表达较高, TLR9最低; 在胚胎中, TLR1显示出高表达水平。Cheng等[52]调查了约克夏和藏猪的胸腺、脾、血液、扁桃体、肠系膜和肺门淋巴结等组织中TLR基因(TLR1-TLR9)的表达模式, 发现所有组织中均检测到所有TLR基因的mRNA表达, 具有广谱的表达特点。在王鹏飞[9]的研究中, TLR3基因在肝、脾、肾和胃中均有较高丰度的表达, 在心脏、肺、大脑、肌肉、子宫、淋巴结、大肠和小肠中表达较低, 而在小脑和扁桃体中几乎检测不到其表达。Á lvarez等[53]发现猪TLR4 mRNA在树突状细胞、单核细胞、巨噬细胞以及骨髓、胸腺、淋巴结、脾、肝、肾脏和卵巢等组织中均有表达。同样地, 邱小田等[54]通过RT-PCR表明猪源TLR4 mRNA在心脏、肝脏、脾脏、肺、肾脏、骨骼肌、胸腺、淋巴结、白质、灰质、睾丸和小肠等12种组织中均有表达, 并且在肺中有最高的表达丰度。JU等[44]通过qRT-PCR定量检测TLR4可变剪接变体的表达, 发现热应激猪的外周血单核细胞中TLR4的选择性剪接变体(TLR4-ASV)的表达水平显著增加。Wang等[55]检测了大白猪、苏太猪和梅山猪中TLR4基因的组织表达谱, 发现TLR4基因在所检测的心、肝、脾、肺、肾、胃、肌肉、胸腺、淋巴、十二指肠和空肠组织中均有表达, 并且在免疫组织中具有相对较高的表达丰度, 但在肺中表达水平最高。Ansari等[56]通过免疫组化技术分析TLR4蛋白在怀孕母猪子宫中的分布, 发现TLR4蛋白在子宫的不同组织学层中均有表达。杨秀芹等[14]发现野猪TLR4和TLR5基因在所检测的各组织内(胃、肾、脾、肺、心、肝、肠和肌肉)都有不同丰度的表达。朱浩妮[57]通过对荣昌仔猪TLR基因的表达发育规律的检测, 发现TLR2、3、4、7、9的表达量在肝脏、脾脏、肺、肠系膜淋巴结和空肠组织中存在明显的差异, 并且总体上随着日龄的增加, 表达量显著增加。Balachandran等[58]通过免疫组化和免疫电子显微镜研究表明, TLR10在猪的肺内血管内皮和平滑肌中均有表达。
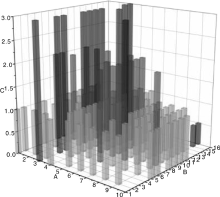
综上, 不同的TLRs具有不同的组织表达水平, 并且在不同时间段的表达水平也有所差异, 不同猪品种之间也存在表达差异。TLRs的表达与机体的免疫调控密切相关, 这也从侧面揭示了不同猪品种、不同生长发育阶段以及不同组织中的TLRs表达在机体免疫应答中发挥的调控作用。图1展示了不同TLRs在所检测的不同组织中的整体表达水平情况, 总体来说在大多数组织中TLR1-TLR10都有表达, 并且TLR3的表达水平相对较高, TLR2和TLR6次之, TLR9和TLR10相对较低, 除了基因本身功能, 这与所报道的文献不是很多也有一定的关系。
人的TLRs信号通路已经被研究的非常深入, 除了TLR10, 其他TLRs的配体均被明确鉴定(图2)。在哺乳动物(包括猪)体内, 识别细胞外微生物成分或结构的TLRs(如 TLR1、2、4、5和 6)表达在宿主细胞膜表面, 识别病毒或细菌核酸成分的TLRs(如 TLR3、7、8和9)表达在细胞内内吞小泡上。与人源类似, 猪源TLRs信号通路也主要分为髓样分化因子88(myeloid differentiation factor 88, MyD88)依赖通路、β 干扰素TIR结构域衔接蛋白(TIR receptor domain containing adaptor inducing interferon-β , TRIF)依赖通路(又称TICAM1依赖通路)[59]、小GTP酶通路[60]和磷脂酰肌醇(PIPs)通路[61]。其中最主要的通路是MyD88依赖通路, 它可以最终激活核因子-κ B(nuclear factor-κ B, NF-κ B), 导致许多目的基因表达上调。所有的TLRs均包含TIR结构域, MyD88的TIR结构域都可与之结合; MyD88依赖通路是除TLR3外所有TLRs的共同通路, 因此MyD88依赖通路是最主要的TLR信号通路[62, 63, 64]。
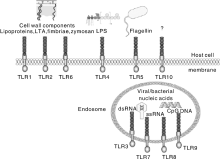 | 图2 人源TLRs及其所识别的微生物相关分子模式(MAMPs) 图片资料引用自文献[68]Fig.2 Human TLRs and their identified microbial related molecular patterns (MAMPs) Image data was cited from the reference [68] |
猪MyD88基因位于猪第13号染色体, 编码293个氨基酸的序列, 与人相比同源性达到87%~88%。其在各组织中广泛表达, 特别是在免疫组织和肠道组织中高表达, MyD88作为TLRs/IL-1R信号通路中一个关键接头分子, 在传递炎症信号和增强炎症强度, 引发肠道炎症介质的释放中具有重要的作用[65, 66]。Dai等[67]发现在MyD88基因沉默的PK15细胞中, TLR4和IL-1β 的转录水平显著降低; 当细胞被LPS(0.1 μ g· mL-1)诱导6 h后, 促炎细胞因子的总体水平均发生上调且IL-1β 、TNF-α 、IL-6、IL-8和IL-12的水平对照组显著高于RNAi组, 揭示MyD88基因沉默后可以减少TLR4信号转导, 抑制促炎细胞因子的释放, 并一定程度上导致免疫抑制。图3主要揭示了MyD88介导的猪源TLRs信号的传导和免疫调控。
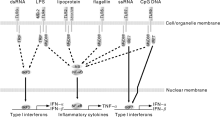 | 图3 猪源TLRs分子诱导的不同类型信号通路的示意图 图片资料引用自文献[69]; 这里显示的只有参与信号通路的代表性分子, 其中虚线箭头表示信号传递, 实线箭头表示分子迁移Fig.3 Schematic illustration of different types of signaling pathway induced by porcine TLR molecules Image data was cited from the reference [69]. Only representative molecules participating in the signaling pathway were shown here. Dotted arrows indicated the transmission of signals. Arrows with solid lines showed the translocation of the molecules |
Muneta等[5]发现抗磷酸TLR2和TLR6抗体能够协同阻断猪肺泡巨噬细胞由猪肺炎支原体刺激的肿瘤坏死因子-α (TNF-α )的产生, 表明TLR2和TLR6对猪肺泡巨噬细胞中识别猪肺炎支原体具有重要的作用。Uenishi等[49]发现猪PRR基因的多态性可能与猪的疾病易感性有关, 并且TLR2的特定等位基因显示出肺炎感染趋势的增加。方晓敏等[70]发现猪TLR4基因C1027A的C等位基因极可能是猪抗支原体肺炎感染的优势基因。刘筱等[71]发现苏钟猪感染肺炎支原体后, 可引起TLR2和TLR4表达的增加以及肺内促炎因子TNF-α 、IL-1β 的释放, 导致肺部炎症反应。Shinkai等[72]发现杜洛克猪TLR5基因中特异单倍型(a/b和a/d)能够引起放线杆菌肺炎支原体(APP)血清型2和5疫苗接种的应答增加。因此, 对这些TLRs确证的影响支原体感染的变异位点的筛选将对猪抗支原体性状的遗传改良产生重要意义。
2.2 TLRs与病毒感染的关系Liu等[73]发现用猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)感染猪后, TLR2、3、4、7、8 的表达量均发生显著上调。Miguel等[74]发现PRRSV的感染增加了支气管淋巴结中TLR3、TLR4和TLR7的mRNA表达水平, 并导致促炎细胞因子表达水平增加。Wang等[75]对猪TLR3基因编码区5个已知的非同义SNP进行分析, 结果发现, SNP c.933A> G能显著降低Poly (I∶ C)反应, 还可导致TLR3基因高度保守的第12亮氨酸重复区域中的保守氨基酸发生改变。Duan等[76]发现, 体外培养的猪淋巴细胞与圆环病毒(porcine circovirus, PCV)2型共孵育时, MyD88蛋白的表达明显增加, 并且TLR1, TLR3, TLR4和TLR9的mRNA表达显著上调, 表明TLR-MyD88-NF-κ B信号通路在PCV2诱导淋巴细胞的免疫过程中发挥了重要的调控功能。王建立等[77]发现PCV2感染初期仔猪出现了免疫应答, 而病毒感染后期, TLR2和TLR4的mRNA表达水平下调, 仔猪免疫应答受到一定程度的抑制; 在病毒感染后28 d, TLR2和TLR4的mRNA表达趋势接近对照组, 即感染后28 d模式识别受体mRNA开始恢复转录水平, 表明此时猪细胞模式识别受体(PRR)的功能也开始恢复, 这样有利于发挥巨噬细胞执行清除病毒的功能。Shinkai等[72]发现杜洛克猪TLR5基因中特异单倍型(a/b和a/d)显示针对丹毒(erysipelas, ER)血清型接种的抗体应答降低。在周敬禹[78]的研究中, 轮状病毒(poreine rotavirus, PRV)感染组中IPEC-J2细胞的TLR3及 NF-κ B的mRNA 表达水平随感染时间延长而不断加强, 且差异显著。曹志[79]发现猪瘟病毒(classical swine fever virus, CSFV)能显著上调TLR2、TLR4和TLR7基因的表达。Brogaard等[80]通过检测猪感染甲型流感病毒(influenza A virus, IAV)前和感染后第1、3和14天的先天免疫因子mRNA转录物的差异表达, 发现TLR4、TLR7和TLR8的表达水平在干扰后24 h发生显著上调, 其中TLR4基因上调到最高水平; 而在第14天, TLR3、TLR4和TNF基因表达开始下调, 并接近未感染水平, 提示感染清除; 猪的IAV感染证实了感染期间和之后免疫因子PRR等的mRNA调节的动态变化, 先天免疫信号的传导在IAV感染过程中发挥了重要的调控作用。Borrego等[81]发现口蹄疫病毒(foot and mouth disease virus, FMDV)模拟物能够触发猪细胞模式识别受体(PRR)参与的快速先天免疫反应, 并发现巴非洛霉素A1能够抑制体外培养的猪外周血单核细胞(PBMCs)内源性TLR3、7、8和9的信号传导。由此可见, TLRs的表达和遗传变异在PRRSV、PCV、ER、PRV、CSFV、IAV和FMDV等病毒的识别以及免疫反应中确实发挥了重要的调控作用, 有必要对其表达调控的分子机制进行进一步分析验证, 深入挖掘对病毒侵染具有抗性作用的遗传标记, 从而实施抗病育种。
王攀等[82]发现TLR2基因表达水平在内毒素脂多糖(Lipopolysaccharide, LPS)刺激在五指山小型猪近交系主动脉内皮细胞后显著升高, 提示TLR2基因能够介导细胞炎症相关因子的表达。Jang等[83]发现喂食鼠李糖杆菌可增加猪气管支气管淋巴结中TLRs和促炎因子TNF-α 的表达, 表明TLRs在鼠李糖杆菌引起的炎症反应中发挥了重要的调控作用。刘筱等[39]发现苏钟猪TLR4编码区C1027A突变能影响TLR4识别内毒素脂多糖(LPS)的能力, 等位基因C为苏钟猪抗革兰阴性菌感染的优势基因。Wang等[84]检测比较了TLR4基因在苏太断奶仔猪F18大肠埃希菌敏感型和抗性型个体中的表达水平, 发现苏太猪大肠埃希菌F18敏感型个体中TLR4表达水平要显著高于抗性型个体, TLR4基因表达的下调与断奶仔猪对大肠埃希菌F18的抗性相关。Finamore等[85]发现产肠毒素大肠埃希菌(ETEC)诱导猪TLR4和MyD88蛋白水平的增加, 磷酸化的IKKα 、IKKβ 、Iκ Bα 和NF-κ B亚基p65以及炎症细胞因子IL-8和IL-1β 的产生。Zhang等[86]发现注射LPS的猪具有较高的TLR4基因表达水平和血浆TNF-α 浓度, 表明TLR4 基因在LPS引起的急性炎症中发挥了重要的调控作用。孙丽等[87]研究发现LPS诱导猪小肠上皮细胞系(IPEC-J2)后TLR4基因及其信号通路关键基因表达水平均发生显著上调, 推测LPS诱导引起TLR4信号途径的信号传递, 再经过级联免疫效应引起下游促炎细胞因子的释放, 最终导致炎症反应。在Radhakrishnan等[88]的研究中, 抑制TLR4信号通路能够缓减高脂肪饮食(HFD)诱导的猪结肠/肠系膜脂肪炎症。Arnal等[89]发现在母猪分娩期间用阿莫西林治疗过的成年后代, 直肠消化道中的结肠碱性磷酸酶(AP)、TLR2和TLR4浓度增加。Guo等[90]通过钩端螺旋体脂多糖(L-LPS)刺激猪成纤维细胞, 发现TLR2在L-LPS刺激后24 h内表达明显上调, 而TLR4表达相对较弱; 同时MyD88、IL-6和IL-8基因表达显著上调, 并推测猪细胞可以通过L-LPS刺激激活TLR2而不是TLR4, 从而诱导细胞因子表达。因此, TLR2和TLR4都在细菌内毒素LPS的侵染过程中发挥了重要的调控作用, TLR4与LPS引起的急性炎症具有密切联系, 而TLR2可能在L-LPS刺激过程中发挥着比TLR4更直接的作用。
TLR5能够识别细菌鞭毛蛋白, 在免疫系统中发挥重要作用。Li等[91]研究发现TLR5基因中的SNP可以改变宿主对鞭毛蛋白的免疫应答, 并且对人类和其他动物感染性疾病的易感性具有影响, G2239A对受体功能有影响。Yang等[92]调查了来自5个猪品种的83个个体中TLR5基因编码区的单核苷酸多态性(SNPs), 鉴定了总共19个中等多态性SNP(0.25< PIC< 0.5), 其中3个是在TLR5的细胞外结构域内聚集的错义突变, 有1个非同义SNP在228个氨基酸的区域, 已被证明对鞭毛蛋白识别非常重要。TLR5作为菌毛蛋白的识别受体, 在细菌侵染的过程中具有举足轻重的作用, 筛选重要的SNP将对免疫应答产生重要的影响。
李文华等[93]建立了2型猪链球菌(Streptococcus suis 2, SS2)感染J774A.1细胞模型, 并发现TLR2基因的mRNA水平在感染SS2后明显上调, 并且感染组TNF-α 含量也极显著升高, 但阻断TLR2后TNF-α 表达显著降低, 提示TLR2基因及其信号通路的活性能够影响SS2引起的细胞自噬作用。朱静等[94]发现SS2荚膜唾液酸成分缺失后能够显著激活宿主单核/巨噬细胞TLR2分子, 导致通路下游AKT磷酸化水平升高, 核转录因子NF-κ B激活, 从而导致炎症因子释放, 使得细菌更加容易被机体识别并清除, 导致毒力下降。TLR2不仅与L-LPS刺激有关, 更与SS2的侵染有密切联系。在一定范围内, TLR2的高表达可能有利于细菌侵染的抗性调控。
选择性剪接是真核生物中的细胞机制, 其导致基因产物的相当多样性, 它在几种疾病和细胞信号调节中起重要作用[95]。热应激是诱导猪免疫抑制的主要因素, 而关于猪的选择性剪接和热应激之间的相关性了解甚少, Ju等[44]研究了猪TLR4基因剪接体的mRNA水平与热应激的关系, 结果发现应激猪中TLR4基因剪接体的mRNA水平显著上调; 与对照猪相比, 热应激组外周血单个核细胞(peripheral blood mononuclear cell, PBMC)中TLR4的选择性剪接变体(TLR4-ASV)的表达水平增加了2~3倍, 提示热休克可能通过调节TLR4及其可变剪接变体的表达调节宿主免疫应答。
自从Toll样受体家族(TLRs)被发现以来, 有关其分子克隆、表达定位和功能鉴定等研究进展非常迅速。由于其在机体免疫反应过程中发挥的重要的调控作用, 已经成为人类、畜禽类甚至鱼类相关生物学功能的研究热点。TLRs可利用MyD88和TRIF等介导的信号传导通路来激活不同的转录因子, 以引起特异性免疫应答。最重要的是, TLRs不仅在天然免疫反应中发挥了重要的作用, 还在一些由支原体、病毒、细菌等感染引起的免疫应答过程中发挥了重要的调控功能。随着分子生物学的迅猛发展, 利用现代高新技术(高通量测序技术、全基因组关联分析、基因编辑技术等), 通过对猪源TLRs进行基因功能和调控的分子机制研究, 发掘有意义的分子标记, 从遗传的角度, 通过提高机体免疫力的分子选育间接提高抗病性能, 将对猪的抗病育种产生深远的影响。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|
| [82] |
|
| [83] |
|
| [84] |
|
| [85] |
|
| [86] |
|
| [87] |
|
| [88] |
|
| [89] |
|
| [90] |
|
| [91] |
|
| [92] |
|
| [93] |
|
| [94] |
|
| [95] |
|