作者简介:王婧(1985—),女,四川绵阳人,博士,讲师,主要从事兽药药理研究。E-mail:kenhtsjj@163.com
为调查江苏省泰州地区引起仔猪腹泻的主要病原,采集腹泻仔猪的肛拭子样品共70份,利用MA琼脂平板共分离得到136株细菌。鉴定结果表明,其中含大肠埃希菌119株、沙门氏菌5株、志贺菌4株、阪崎肠杆菌8株。致病性试验确定其中有81株细菌为致病性大肠埃希菌,对其进行O抗原血清型鉴定,有36株分离菌被定型,分属于6种血清型,以O78和O101为优势血清型。进一步对分离得到的大肠埃希菌进行肠毒素基因检测,结果表明,这些大肠埃希菌中包含ST1+ST2型20株、LT1+ST2型44株、ST2型17株,共3种产肠毒素类型。药敏试验结果显示,超过75%的菌株对头孢他啶、阿米卡星和氧氟沙星表现为敏感,而对常用的四环素、头孢呋辛、卡那霉素、多西环素等呈现耐药性,且存在严重的多药耐药现象。研究结果可为泰州地区仔猪腹泻的预防和治疗提供参考依据。
In order to investigate the main causes of diarrhea of piglets in Taizhou, Jiangsu Province, 70 rectal swab samples were collected from the live diarrheic piglets, and 136 strains of bacteria were isolated by MA plates, in which 119 strains of Escherichia coli, 5 strains of Salmonella, 4 strains of Shigella, 8 strains of Cronobacter sakazakii were characterized by biochemical identification and 16S rDNA gene sequence analysis. 81 strains of pathogenic E. coli were confirmed according to the animal test. Among them, 36 strains of pathogenic E. coli were identified belonging to 6 serotypes by agglutination tests, and the predominant serotypes were O78 and O101. In addition, among 81 pathogenic E. coli, 20 isolates were ST1+ST2, 44 isolates were LT1+ST2,while others were ST2. The drug resistance of pathogenic isolates were tested by Kirby-Barer method, and the results showed that more than 75% pathogenicity isolates were sensitive to ceftazidime, amikacin and ofloxacin, but resistant to tetracycline, cefuroxime, kanamycin and doxycycline seriously,and there were serious multi-drug resistance. These results would provide scientific data for the prevention and control of porcine postweaning diarrhea disease in Taizhou area.
仔猪腹泻是养猪行业中常见的一类疾病, 且发病率居高不下, 给养猪业带来巨大的困扰。引起仔猪腹泻的原因较为复杂, 可分为传染性病原感染和非传染性因素两类, 其中非传染性腹泻主要由营养、环境应激等原因导致。由于断奶仔猪体温调节能力差、缺乏先天免疫力、消化器官不发达、消化腺功能不完整等, 使得病原微生物有机可乘。一旦仔猪发生腹泻, 将给养殖户造成巨大的经济损失。细菌、病毒、寄生虫等传染性病原感染是造成仔猪腹泻的另一类因素, 会诱发传染性胃肠炎、流行性腹泻、仔猪黄白痢等。其中, 致病性大肠埃希菌感染, 如产肠毒素大肠埃希菌(ETEC)和携带耶尔森氏菌强毒力岛(HPI)的大肠埃希菌等[1, 2, 3, 4, 5], 主要危害1月龄以内的仔猪, 引起仔猪黄痢、白痢, 是猪场中最常见的仔猪腹泻类型[6], 发病率和死亡率均较高。
本研究以在江苏省泰州市所辖部分发病猪场采集的仔猪腹泻肛门拭子为研究对象, 进行致病性大肠埃希菌病原的分离和鉴定, 及常规药敏检测, 以明确当地的致病性大肠埃希菌药物敏感特性, 为该病的防治提供依据。
2016年11月— 2017年1月在江苏省泰州市所辖地市区、泰兴、姜堰等5个猪场共采集70份腹泻仔猪的肛拭子样本, 其中市郊猪场采样10份, 其他4个猪场每个采样15份。发病仔猪主要表现为精神不振、食欲不佳、拉稀等。以灭菌棉拭子采集发病仔猪肛拭样品置于灭菌离心管中, 保存于-70 ℃冰箱备用。
麦康凯琼脂培养基(MA)购于杭州百思生物技术有限公司; 酵母提取物、胰蛋白胨购自英国OXOID公司; 细菌微量生化反应鉴定管和药敏纸片均购于杭州滨河微生物试剂有限公司; PCR相关试剂均购自大连宝生物试剂公司; 大肠埃希菌单因子抗O血清购自中国兽药监察所, 包括O2、O5、O8、O11、O20、O40、O45、O54、O64、O78、O101、O138、O139、O141、O147、0149; 药敏纸片包括头孢呋辛、头孢吡肟、氧氟沙星、庆大霉素、红霉素、四环素、多西环素等17种。
将采集的棉拭子接种于5 mL营养肉汤中, 37 ℃振荡培养6 h, 然后取少量培养物均匀涂布于MA琼脂平板, 于37 ℃倒置培养18~24 h, 挑取单个疑似菌落至LB液体培养基进行增菌, 保存备用。另取少量纯培养的细菌涂片, 进行革兰氏染色, 镜检, 观察菌体形态和染色特性。
根据细菌微量生化反应管检验方法操作指南对分离培养的菌株进行常规生化鉴定, 主要包括葡萄糖、果糖、乳糖、枸橼酸、鸟氨酸、赖氨酸、精氨酸等10项, 接种后将微量生化反应管置于35 ℃恒温培养18~24 h后观察并记录结果, 培养基呈黄色即为阳性反应, 反之则为阴性。
对生化鉴定结果不能确定的菌株进行PCR测序鉴定。取分离菌株500 μ L, 9 000 g离心5 min, 去除上清后重悬于100 μ L灭菌超纯水, 然后采用煮沸法制备各菌株的DNA模板备用。利用细菌16S rDNA通用引物(27F/1492R), 根据参考文献[1]配制25 μ L扩增体系并进行PCR反应。反应结束后, 取5 μ L PCR产物进行1.5%琼脂糖凝胶电泳, 观察结果。预期电泳条带为1 465 bp, 将电泳结果中具有单一目的条带的PCR产物送上海生物工程有限公司进行测序, 并对测序结果进行分析。
动物试验选择18~22 g的清洁级昆明小鼠, 以分离鉴定的菌株普通肉汤培养物作为接种液, 每株菌接种2只小鼠, 分别腹腔注射0.4 mL接种液(含菌量约为2.4× 108 cfu), 同时以灭菌普通肉汤作为对照组。注射后对小鼠进行分笼隔离饲养, 并观察小鼠的临床表现, 记录小鼠死亡时间, 并对死亡小鼠进行剖检观察, 24 h内死亡者判定为致病性菌株。
根据中国兽药监察所大肠埃希菌O抗原血清型鉴定说明书进行操作。将动物试验结果为致病性的大肠埃希菌接种于MA平板上, 37 ℃培养24 h, 取光滑圆整的玫红色菌落1~2个接种至半固体培养基。取半固体培养物接种于普通琼脂斜面, 37 ℃培养24 h, 用2 mL苯酚生理盐水洗下培养物成浓稠悬液, 于121 ℃高压2 h破坏K抗原, 用高压后的抗原进行玻板凝集试验。
检测不耐热肠毒素LT1, 耐热肠毒素ST1和ST2基因, 引物根据参考文献[7]由上海生物工程公司合成(表1), 检测方法同参考文献[7]。DNA模板制备方法同1.5节, 利用上述引物配制25 μ L扩增反应体系进行PCR反应, 按照文献方法对所有动物试验结果为致病性大肠埃希菌的细菌进行肠毒素PCR检测。反应结束后, 取5 μ L PCR产物进行1.5%琼脂糖凝胶电泳, 观察结果。
| 表1 致病性大肠埃希菌相关毒力基因引物序列 Table 1 Primers used for amplification of virulence genes |
用纸片法对上述鉴定得到的致病性大肠埃希菌进行药敏试验, 根据美国临床实验室标准委员会公布的标准, 按抑菌圈直径大小依敏感、中介和耐药3种形式进行判断[6], 为临床治疗选择敏感药物提供依据。
将采集的70份仔猪腹泻肛拭子进行增菌后少量涂布于MA琼脂平板上, 37 ℃培养18~24 h, 培养后可见MA琼脂平板上生长的单个菌落形态主要为圆形, 表面光滑, 颜色为玫红色, 疑似大肠埃希菌。个别MA平板出现少量无色透明的圆形单个菌落, 疑似沙门氏菌。分别挑取2种特征的单个菌落接种于LB肉汤培养基中进行增菌, 随后取少量菌液进行革兰氏染色和镜检, 共分离得到136株细菌。镜检发现, 这些分离的细菌多呈革兰氏阴性, 中等大小, 单个存在, 系两端钝圆的杆菌。
将分离得到的136株新鲜菌液接种于细菌生化鉴定微量反应试管, 置于35 ℃培养箱静置培养18~24 h, 读取结果。根据生化试验结果, 参照伯杰氏细菌鉴定手册, 分离得到的136株细菌中鉴定出大肠埃希菌108株、沙门氏菌3株、阪崎肠杆菌2株, 其他不确定的细菌23株。
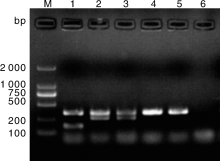
对未定型的23株细菌的16S rDNA进行扩增测序, 扩增产物1 465 bp(图1)。对测序结果进行BlastN比对分析得出, 这23株细菌中包括大肠埃希菌11株、沙门氏菌2株、阪崎肠杆菌6株、志贺菌4株。
 | 图1 细菌16S rDNA的PCR检测M, DNA Marker DL2000; 1, 阴性对照; 2~6, 未定型菌株Fig.1 Detection of 16S rDNAM, DNA marker DL2000; 1, Negtive control; 2-6, Undefined strains |
结合生化鉴定结果, 所分离得到的136株细菌分别系大肠埃希菌119株、沙门氏菌5株、志贺菌4株、阪崎肠杆菌8株。
在致病性试验中, 136株受试菌中共有致病性菌株81株(均系大肠埃希菌), 55株无致病性。大部分致病性菌株接种2~3 h后, 小鼠开始出现精神萎顿、身体蜷缩、被毛凌乱等症状, 部分菌株试验动物可观察到腹泻症状, 少部分动物在接种6 h后开始出现死亡, 大部分于接种12 h以后死亡。对病死小鼠进行剖检, 主要病理变化包括:心包积液, 心冠脂肪瘀血肿大, 胸腔内有少量渗出物; 肺有出血点, 部分动物肺有坏死; 肝脏质地脆弱, 瘀血, 坏死; 脾脏肿大; 肠道黏膜薄且肠道内有气体等。试验结束时将对照组小鼠处死, 剖检后未见肉眼可见病变。对病死小鼠脏器进行细菌学检测, 分离到的细菌与接种细菌的革兰氏染色、生化检测结果一致。
试验过程中发现有2株沙门氏菌和1株志贺菌可引起小鼠腹泻, 但是并不引起小鼠死亡, 因此认为沙门氏菌和志贺菌不是引起动物腹泻的主要病原, 后续血清型鉴定和药敏试验只针对致病性的大肠埃希菌。
玻板凝集试验结果(表2)表明, 81株大肠埃希菌中有36株定型, 分属于6种血清型, 分别是O2、O8、O64、078、O101、O149, 以O78和O101为主要流行血清型, 占本次定型菌株的63.9%。另外45株未能定型, 占致病菌株的55.6%。
| 表2 大肠埃希菌分离株O抗原血清型分布 Table 2 Distribution of O-serogroups among pathogenic E. coli isolates |
对分离得到的81株大肠埃希菌进行肠毒素类型的PCR检测。电泳结果表明, 分离得到的81株大肠埃希菌中共存在3种肠毒素类型(图2):ST1+ST2型20株, LT1+ST2型44株, ST2型17株。
从表3可知, 头孢他啶对所有致病菌的敏感性最好, 敏感株占80.2%, 其次是阿米卡星、氧氟沙星, 敏感菌株占75%以上。不同猪场的敏感性药物各有不同, 其中1个猪场分离菌对氧氟沙星的敏感性最佳, 1个猪场分离菌对头孢他啶和头孢哌酮敏感性最佳, 另外2个猪场分别对头孢他啶、阿米卡星最为敏感, 还有1个猪场对头孢他啶和米诺环素敏感性较好。
药敏试验发现, 这些致病性大肠埃希菌对四环素的耐药性表现最为严重, 耐药菌株达到87.7%, 只有4.9%的致病菌对四环素表现为敏感。这些菌株对头孢呋辛、头孢曲松、卡那霉素、多西环素、环丙沙星等也表现出较为严重的耐药性, 超过50%以上的菌株对上述抗菌药表现为耐药。5个猪场分离的菌株耐药性最严重的均为四环素, 其他几种药物耐药性表现不一。同时, 这些致病菌也表现出严重的多重耐药现象, 且几乎所有菌株的多药耐药谱都不一样。本次试验共使用17种抗生素, 出现14耐和15耐的细菌各1株(表4), 大部分菌株表现出对6~12种抗菌药具有耐药性。各菌株具体的耐药表型见表5。
| 表3 致病性大肠埃希菌的药敏试验结果 Table 3 Drug sensitivity of pathogenic E. coli |
| 表4 致病性大肠埃希菌的多重耐药性 Table 4 Multidrug resistance of pathogenic E. coli |
| 表5 致病菌株的多药耐药谱型 Table 5 Drug resistant spectrum of all pathogenic isolates |
临床上引起仔猪腹泻的病原较为复杂, 其中由产肠毒素大肠埃希菌(ETEC)引起的仔猪腹泻尤其常见, 也是导致仔猪腹泻的重要病原之一。大肠埃希菌O抗原血清型众多, 目前资料报道已确定的有100多种, 优势血清型主要是O8、O78、O138、O139、O141、O147、O157等[8, 9, 10], 常规多价苗免疫效果不理想[11], 较难预防, 给养猪业造成了巨大经济损失, 因此对ETEC的早期诊断对临床治疗具有重要意义。
本试验对引起江苏省泰州市辖区内5个猪场仔猪腹泻的细菌性病原进行了分离、鉴定和药敏试验。70份样本共分离到136株细菌, 致病性试验证明, 共81株致病性大肠埃希菌, 部分样本分离到2株以上致病菌。分析发现, 分离到2株以上致病菌的样本多数为混合感染, 主要表现为这些菌株的耐药谱或血清型有所不同, 也有少量样本可能分离到了相同菌株。分离到的其他菌株通过试验证实, 并不是引起仔猪腹泻的主要原因。本试验分离到少量阪崎肠杆菌, 这是一类广泛存在于自然界的条件性致病菌, 而动物试验时未发现这类细菌引起动物产生临床症状, 这可能是由于有一个采样的猪场卫生情况较差, 圈舍内蝇虫较多, 地面排泄物清理不及时所引起的。
本次试验致病性大肠埃希菌O抗原优势血清型为O78和O101, 且5个猪场的血清型分布各有不同, 所有猪场存在至少2种血清型, 甚至有一个猪场同时检测出4种血清型。总的来说, 5个猪场中有2个猪场同时检测出O78和O101的存在, 2个猪场以O78为主要流行血清型, 1个猪场以O101和O149为主。而袁玉国等[12]对江苏中部地区的猪大肠埃希菌血清型研究结果显示, 优势血清型为O9和O107。还有研究表明, 江苏部分地区仔猪腹泻大肠埃希菌以O6、O9、O20、O101等为优势血清型[13]。与前述研究的优势血清型略有不同, 可能是由于本试验对致病性大肠埃希菌的O抗原检测使用的是单因子血清, 所选择使用的单因子血清种类不同, 且未使用O抗原多价血清进行初步检测, 导致多数菌株未能定型, 而使最终统计出的优势血清型有所差异。
进一步对其毒力基因进行鉴定表明, 引起此次仔猪腹泻的ETEC包含ST1+ST2、LT1+ST2、ST2三种肠毒素类型。袁玉国等[12]对苏中地区的猪大肠埃希菌病原的毒力基因调查结果显示, 30.3%的菌株携带肠毒素LT基因, 39.2%携带ST1基因, 64.8%携带ST2基因; 而本次检测所有的分离菌株均携带ST2基因。王景[14]的研究结果显示, 江苏地区初生仔猪腹泻大肠埃希菌的肠毒素类型以ST1和LT为主要类型, 而携带ST2肠毒素基因的大肠埃希菌大约只占8%。但也有研究表明, 在江苏地区引起仔猪腹泻的大肠埃希菌的肠毒素基因携带类型以LT和ST2为主[13], 但这些研究的调查地区并不明确, 也有可能是由于近年来ST2的肠毒素基因分布逐步变广所致。
近年来, 养殖业为了预防细菌感染和降低动物患病风险, 常在饲料或饮水中添加大量的抗菌药物, 致使细菌耐药性问题日趋严重, 这也使得同种细菌在不同地区甚至不同养殖场对同种药物表现出较大的敏感性差异; 因此, 在临床上治疗细菌性疾病应先进行药敏测试, 选择敏感药物进行临床治疗[15]。有研究表明, 在江苏徐州地区, 猪大肠埃希菌耐药性强, 且耐药谱广, 对四环素、多种青霉素、环丙沙星、头孢曲松等常用药物均表现出具有较高的耐药性[16]。本试验结果表明, 引起泰州市区仔猪腹泻的病原菌对四环素耐药最为严重, 对头孢呋辛、头孢曲松、卡那霉素、多西环素、萘啶酸、环丙沙星也表现出较严重的耐药性, 与徐州地区的猪大肠埃希菌耐药谱较相似, 同时还检测到有对14、15种抗菌药呈现耐药性的菌株, 超过75%的菌株对头孢他啶、阿米卡星和氧氟沙星的敏感性较高。研究结果可为临床用药提供参考。
(责任编辑 卢福庄)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|