作者简介:王向东(1976—),男,河北承德人,博士,助理研究员,从事作物遗传与育种研究。E-mail:cauwang@qq.com
利用ISSR分子标记技术对不同地区的11种荆芥种质资源进行分析,以此来探讨我国荆芥种质资源的遗传多样性。以11种荆芥幼苗为材料,CTAB法提取其基因组DNA;采用正交试验优化ISSR技术体系影响因素;利用100条ISSR引物进行ISSR扩增,最后计算供试材料之间的遗传距离并进行聚类分析。结果表明,最优ISSR-PCR体系,在25 μL体系中,模板DNA 50 ng,引物0.75 μmol·L-1, Taq DNA聚合酶1 U;100条引物中55条引物可扩增出结果,共扩增出458条条带,平均每个引物扩增出8.3条,其中246条为多态性带,多态性比率为53.71%;11个荆芥种质资源的遗传距离在0.208 3~0.709 1;在遗传距离为0.50处,可将供试的11种荆芥材料分为2大类;在遗传距离为0.40处,可将供试的11种荆芥材料分为5大类,研究结果表明我国荆芥种质资源遗传多样性较低。
The aim of the study was to analyze the genetic diversity of 11 Schizonepeta tenuifolia Briq.using ISSR, which would investigate the genetic diversity of Schizonepeta tenuifolia Briq. germplasm resources in China. With 11 kinds of Schizonepeta tenuifolia Briq. seedlings as materials, genomic DNA was extracted using the CTAB method. An orthogonal design was used to optimize the ISSR-PCR amplification system. 100 ISSR primers were used in the ISSR amplification. At last it counted the genetic distance between the tested materials and finally the cluster analysis was done. The results showed that a suitable ISSR reaction system was constructed with 25 μL reaction system containing 50 ng DNA, 0.75 μmol·L-1 primer and 1 U Taq DNA polymerase. There were 55 primers amplified from the 100 primers, 458 bands were amplified, 8.3 bands were amplified from each primer, of which 246 bands were polymorphic, and the polymorphic rate was 53.71%. The genetic distances of 11 Schizonepeta tenuifolia Briq. germplasm resources were between 0.2083-0.7091. When the genetic distance was 0.50, 11 kinds of materials could be divided into 2 categories. When the genetic distance was 0.40, 11 kinds of materials could be divided into 5 categories. In conclusion, the genetic diversity of germplasm resources of Schizonepeta tenuifolia Briq. was lower in China.
荆芥(Schizonepeta tenuifolia Briq.)为唇形科草本植物荆芥的干燥地上部分, 始载于《吴普本草》[1]。荆芥主治感冒头痛、风疹、咽喉肿痛等病症, 为中医临床上的常用药物[2, 3]。现代荆芥以人工栽培为主, 主要分布在江苏、浙江、河北、东北三省等地, 其中河北安国荆芥和浙江萧山荆芥最为有名[4]。前人对荆芥的研究主要在栽培方法、炮制加工、化学成分、药理作用和临床应用等方面, 如有学者对荆芥的高产栽培技术[5]、大田栽培技术[6]、规范化生产栽培技术[7]等进行过研究。周丽娜[8]对荆芥的化学成分就药理作用进行了研究, 结果表明, 荆芥具有抗病毒、抗氧化等药理作用。何婷等[9]发现, 荆芥挥发油、薄荷酮和胡薄荷酮治疗方式给药, 显示出体内抗病毒作用。还有学者发现, 荆芥穗可应用于荨麻疹、水痘、流行性腮腺炎、鼻窦炎等[10]。
ISSR(inter-simple sequence repeat)分子标记技术是利用PCR扩增进行检测的DNA分子标记[11]。该标记技术具有模板需求量少、多态性丰富、操作简单、重复性好、信息量大等优点[12], 目前ISSR标记已广泛运用于植物种质资源的遗传多样性检测与评价以及基因定位、进化及分子生态学等方面的研究[13]。目前关于荆芥种质资源遗传多样性方面的研究比较少, 刘红彬等[14]曾研究了基于ITS序列的不同产地裂叶荆芥系统发育; 本实验室利用RAPD分子标记技术、AFLP技术和ITS序列分析技术对不同产地的荆芥进行过遗传多样性分析[15, 16]。高峰[17]利用ISSR技术对不同产地荆芥进行过遗传多样性分析, 而他选用的引物仅为12条, 选择的荆芥材料分布也较集中。鉴于此, 本研究拟利用ISSR标记技术, 选用100条引物, 对供试11份荆芥种质进行分析, 旨在研究荆芥种质资源的遗传多样性, 为进一步筛选和保存荆芥优质种源奠定基础。
11种荆芥材料名称及来源见表1。供试的荆芥种子来自河北、安徽等省, 3号和4号材料由北京同仁堂河北中药材有限公司提供, 其他由课题组成员购自当地中药材市场。其中1号和3号为春播品种, 其他均为夏播品种。春播品种于3~4月播种, 夏播品种于6~7月播种。
| 表1 供试荆芥材料编号及来源 Table 1 Samples number and origin of tested Schizonepeta tenuifolia Briq. materials |
1.2.1 试剂
β -巯基乙醇、异丙醇、氯仿、无水乙醇、TE缓冲液和双蒸馏水, 以上试剂均购自上海生工, 为分析纯。ISSR-PCR扩增所用的 Taq DNA聚合酶 购自北京百泰克生物技术有限公司。
1.2.2 仪器
提取DNA的CTAB植物基因组DNA快速提取试剂盒购自北京艾德莱生物科技有限公司。ISSR-PCR扩增在Biometra公司的PCR仪上进行, 电泳结果在Bio-Rad仪上拍照, 记录电泳结果。
1.3.1 DNA的提取
DNA的提取参照CTAB基因组DNA快速提取的方法进行[18]。
1.3.2 ISSR-PCR体系正交试验设计
参考王跃虎等[19]优化的荆芥ISSR-PCR反应体系, 对DNA模板用量、引物用量、Taq酶的用量进行3因素4水平优化(表2)[20]。
| 表2 ISSR-PCR反应体系体系设计 Table 2 Design of ISSR-PCR |
利用L16(43)正交实验设计[21], 随机选用1号、6号、9号荆芥材料, 用引物UBC855进行扩增。ISSR-PCR扩增程序为:94 ℃预变性5 min; 94 ℃变性30 s, 退火30 s, 72 ℃延伸1 min, 35个循环; 最后72 ℃延伸5 min, 4 ℃保存[22]。
1.3.3 ISSR-PCR产物的琼脂糖凝胶检测
ISSR-PCR反应结束后, 取扩增产物6 μ L, 3 μ L loading buffer溶液染色后, 在含有EB的1.8%琼脂糖凝胶中检测, 电压为5 V· cm-1, 最后于凝胶成像系统拍照并记录结果。
1.3.4 ISSR引物退火温度的筛选
100条ISSR引物参照加拿大哥伦比亚大学(UBC)公布的ISSR引物序列设计, 由北京睿博兴科生物技术有限公司合成。在比引物Tm值低3 ℃的基础上, 设置5~6个退火温度梯度[23, 24]。选用1号材料在已经优化的反应体系和扩增程序下对每一个引物进行退火温度的筛选。
1.3.5 ISSR扩增并检测
用100条引物对11种荆芥进行ISSR分析, 然后用浓度为1.8%的琼脂糖凝胶电泳进行检测。
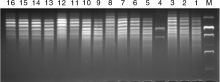
将提取出来的11种荆芥基因组DNA进行5 V· cm-1电压下电泳45 min, 凝胶成像系统拍照并记录, 结果如图1所示。可以看到提取的11种样品的条带都十分清晰, 总DNA电泳位置近乎一致, 证明提取的基因组DNA纯度可靠。
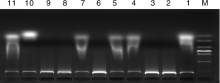
随机选用1号, 6号, 9号材料, UBC855引物进行正交优化, 从1号材料的扩增结果(图2)中可看出, 第3、4、6、7、11、12、13、14、15组的扩增条带多、清晰、整齐; 从6号材料的扩增结果(图3)中可看出, 第3组和第4组的扩增条带较清晰整齐; 从9号材料的扩增结果(图4)中可看出, 第3组和第8组的扩增条带较多, 且清晰、整齐, 综合考虑试验结果的准确性和节省DNA模板, 因此选用3号体系为11种荆芥ISSR-PCR试验的最优体系, 最优反应体系为:模板DNA 50 ng, 引物0.75 μ mol· L-1, Taq DNA聚合酶1 U, ddH2O 补充至25 μ L。
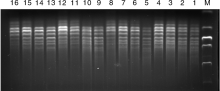 | 图2 引物UBC855对1号荆芥的ISSR结果Fig.2 ISSR amplification results for primer UBC855 to No.1 Schizonepeta tenuifolia Briq. |
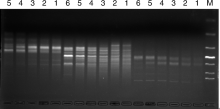
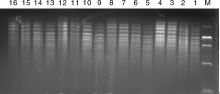 | 图3 引物UBC855对6号荆芥的ISSR结果Fig.3 ISSR amplification results for primer UBC855 to No.6 Schizonepeta tenuifolia Briq. |
选用1号材料对每一个引物进行退火温度的筛选, 筛选结果如表3。图5为引物UBC853、UBC855、UBC858(从右至左)的温度筛选结果。
| 表3 实验所用的55条引物的序列及退火温度 Table 3 Sequence and annealing temperatures of fifty-five primers |
用55条引物在11种荆芥材料中总共扩增出458个条带, 其中多态性带为246条, 多态性比率为53.71%, 平均每个引物扩增出8.3个多态性条带, 扩增条带最多的是引物UBC809和引物UBC824, 扩增条带为13, 多态性条带分别为6、11, 扩增条带最少的为UBC895, 扩增条带为1, 多态性条带为1。ISSR引物及其扩增产物的多态性水平如表4所示。
| 表4 ISSR引物及其扩增产物的多态性水平 Table 4 Primers of ISSR and polymorphism level of their amplification products |
2.5 11种荆芥材料的遗传距离分析
利用55个ISSR引物在11份荆芥材料中所得的458条扩增带, 根据结果计算材料间的遗传距离[27], 不同荆芥种质资源基于ISSR的遗传距离结果见表5, 结果表明, 供试的11个荆芥样本间的遗传距离在0.208 3~0.709 1, 表明这些荆芥样本之间的遗传距离较近, 亲缘关系差别不大。其中来自安国的荆芥春播和秋播遗传距离较近为0.287 4, 来自玉田的荆芥秋播和春播遗传距离最近为0.208 3, 说明来自同一地区遗传距离较近。而6号和10号荆芥材料的亲缘关系最远, 遗传距离为0.709 1; 其次为8号和10号荆芥材料, 遗传距离为0.647 1; 亲缘关系最近的是3号和4号荆芥材料, 遗传距离为0.208 3, 其次为1号和2号荆芥材料, 遗传距离为0.287 4。
| 表5 11个供试材料基于ISSR的遗传距离 Table 5 Euclidean distance among 11 materials based on ISSR analysis |
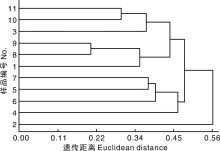
用UPGMA方法对55条ISSR引物的扩增结果进行聚类分析, 结果如图6所示。从图中可看出, 亲缘关系较近的中聚类时距离较近[28, 29]。11种荆芥材料都聚在遗传距离为0.20~0.56的类群中。在遗传距离为0.50处, 可将供试的11种荆芥材料分为2大类, 第一大类包括2号荆芥; 第二大类包括1号、3号、4号、5号、6号、7号、8号、9号、10号、11号荆芥, 其中8号和9号荆芥材料的亲缘关系比较近, 10号和11号荆芥材料的亲缘关系比较近。在遗传距离为0.40处, 可将供试的11种荆芥材料分为五大类, 第一类为3号、10号和11号荆芥材料, 其中10号和11号材料的亲缘关系比较近; 第二大类为1号、8号和9号荆芥材料, 其中8号和9号材料的亲缘关系比较近; 第三大类为5号、6号和7号荆芥材料, 其中5号和7号的亲缘关系比较近; 第四大类为4号荆芥材料; 第五大类为2号荆芥材料。
对遗传背景、遗传结构和种质资源的遗传关系进行研究, 可为提供优良品种的选育提供帮助[30]。因此, 一个或更多的可靠的分子鉴定方法是必要的。ISSR多态性较丰富, 能进行种质资源和遗传多样性的分析。本实验通过ISSR-PCR用55个ISSR引物扩增11个市场流通的南北荆芥样本, 结果显示多态性比率为53.71%, 这表明荆芥遗传多样性受到了一定的破坏。其中一些样本的种质资源不同, 但遗传距离在0.208 3~0.709 1, 表明其遗传关系密切, 表明ISSR可以对具有较近遗传距离的个体进行相对较高的多态性检测, 并检测到具有远亲缘关系的种质资源, 表明ISSR技术可用于具有远遗传距离的种质资源。本研究中, 发现3号河北玉田和4号河北玉田荆芥材料亲缘关系最近, 其次为1号和2号河北安国荆芥材料; 浙江萧山和江苏省荆芥材料的亲缘关系最远; 其次为甘肃省和江苏省荆芥材料; 但聚类结果中来自河北、安徽亳州、浙江萧山、山西、甘肃、新疆、江苏、四川省等地的荆芥种质资源, 虽南北各异, 却聚类在了一起, 这就表明有可能全国各地种质资源引种频繁, 不同地域引种混乱, 导致各省的荆芥亲缘关系较近, 品种混杂, 缺乏一定的规范与标准, 应当大力加强荆芥种质资源的保护。
高峰[17]对不同产地荆芥利用ISSR技术进行遗传多样性分析, 发现裂叶荆芥的遗传多样性为50.93%, 低于同科中广藿香的种内遗传多样性, 两者比较表明裂叶荆芥的遗传多样性已经受到了一定程度的破坏, 应当加强种质资源的保护, 与本研究结果较一致。马艳芝[16]采用AFLP标记和ITS序列分析研究不同荆芥种质资源, 发现荆芥AFLP标记多态性不高(63.90%), 聚类结果中亲缘关系较近或引种频繁地区较近种质资源聚类在一起, 与本研究结果较一致。本研究发现, 虽1号和2号荆芥材料, 3号和4号荆芥材料的遗传距离较近, 但在聚类时却没有首先聚在一起, 可能是由于长期大面积连年种植, 不科学引种等各种原因, 导致群体混杂、种质退化, 从而影响了荆芥药材的整齐度和品质。而来自南北各地的荆芥种质资源却聚类在了一起, 这就表明有可能全国各地种质资源引种频繁, 导致各省的荆芥亲缘关系较近。
另外马艳芝等[15]还采用RAPD技术对不同产地的荆芥种质资源进行分析, 发现11种荆芥材料的遗传距离在0.133 3~0.777 8, 种质资源遗传差距不大, 遗传多样性不高, 与本研究的结果基本一致。本研究基于ISSR分析技术, 发现11种荆芥遗传距离在0.208 3~0.709 1, 但聚类结果与材料来源地的远近距离的分类结果并不是完全一致的, 在一定程度上有相关性, 这有可能是各地荆芥引种频繁、不同地域引种混乱导致的, 应大力加强荆芥种质资源的保护。
(责任编辑 张 韵)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|