作者简介:曹艳(1985—),女,山西吕梁人,博士,助理研究员,主要从事发酵食品研究。E-mail: caoyan_115@163.com
为提高黄酒生产过程中浸米水的利用率、减少其排放量,对比了浸米水与自然发酵椰子水的理化指标差异,分析各指标与细菌纤维素(BC)产量的相关性,继而优化浸米水培养基组分,并研究所得BC的理化性状。结果表明,浸米水中果糖、葡萄糖、蔗糖、乙酸、总蛋白含量显著( P<0.05)低于自然发酵椰子水,它们对BC产量均有显著( P<0.05)影响。以浸米水为原料生产BC的最适碳源为35.0 g·L-1葡萄糖,最适氮源为酵母浸提物和胰蛋白胨混合物(各3.0 g·L-1)。经优化后,BC产率(以干质量计)达到9.3 g·L-1。以浸米水和自然发酵椰子水为原料生产的BC均具有纳米级多孔网状微结构,两者的含水量、持水力和硬度无显著差异,红外光谱和X-射线衍射分析结果显示,其化学组成均为 β-型葡聚糖、Ⅰα型纤维素,结晶度分别为82.7%和84.6%。以浸米水和自然发酵椰子水为原料生产的BC理化性状基本相同,说明浸米水可用作BC的生产原料。
In order to utilize rice milk effectively and reduce its discharge amount, the differences in the physicochemical indexes between rice milk and naturally fermented coconut water were compared, and the correlation analysis within physicochemical indexes and bacterial cellulose (BC) yield was conducted. The BC production based on rice milk medium was optimized, and some physical properties and chemical composition of the produced BC were investigated. The results showed that the contents of fructose, glucose, sucrose, acetic acid and protein in rice milk were significantly ( P<0.05) lower than those in the naturally fermented coconut water, and these substances affected BC yield significantly ( P<0.05). The optimal fermentation condition for rice milk was as follows: 35.0 g·L-1 glucose as carbon source, and mixture of 3.0 g·L-1 yeast extract and 3.0 g·L-1 tryptone as nitrogen source. After optimization, the BC yield could reach 9.3 g·L-1 (dry weight). BCs produced from either rice milk or the naturally fermented coconut water had nano-porous microstructure, and there was no significant difference in the water content, water holding capacity and hardness between them. Infrared spectroscopy and X-ray diffraction analysis showed that BCs produced from either rice milk or the naturally fermented coconut water were composed of β-glucan and type Ⅰα cellulose, and the crystallinity was 82.7% and 84.6%, respectively, indicating that BCs produced from rice milk and the naturally fermented coconut water were almost the same. Therefore, rice milk would be a promising material to produce BC.
细菌纤维素(BC)是由木醋杆菌产生的一类胞外大分子多糖, 与植物纤维一样, 由葡萄糖分子以β -1, 4-糖苷键聚合而成[1]。但是, BC具有植物纤维无法比拟的优点, 如吸水性强、纯度高、结晶度高, 以及生物适应性强、机械强度高等[2, 3]。BC作为食品配料(称为椰果或纳塔), 可改善食品的口感和品质, 在国际市场上畅销不衰[2, 4]。此外, BC还可用作造纸、化妆品、声学器材、医药等领域的新型材料[2, 5]。因此, BC的需求量逐年增加。目前, 规模化生产BC的主要原料为自然发酵椰子水(以下简称椰子水), 产率为10~14 g· L-1[6], 国内仅海南少量生产BC, 大部分从越南等东南亚国家进口。
已有研究报道表明, 水果汁, 以及富含糖和氮的农副产品加工副产物均可作为生产BC的原料[7, 8, 9]。浸米水是黄酒酿造过程的主要副产物之一, 稻米中的淀粉、蛋白质、维生素等物质在浸米过程中溶出, 大量乳酸菌和酵母菌在其中生长代谢, 产生糖类、氨基酸和有机酸等营养物质[10]。目前, 浸米水主要经过沉降和曝气处理后排放[11, 12], 处理成本较高, 但若不经处理直接排放, 则会造成严重的环境污染。杨一冲等[13]的研究表明, 椰子水pH值在2.0~3.0, 其中, 以乳酸、乙酸和乙醇最多。浸米水与椰子水外观看起来相似, 也含有乳酸等有机酸, 但直接以浸米水为原料发酵BC产量非常低, 这可能是由于其中的某些关键组分在含量上有较大差别。本研究对比了浸米水与椰子水中糖类、蛋白质、乳酸、乙酸和乙醇含量的差异, 并分析其与BC产量的相关性, 确定影响浸米水发酵生产BC的主要因素, 优化以浸米水为原料的发酵培养基组分, 研究所得BC的常规性质和化学组成, 为扩大BC生产原料范围和高效利用浸米水提供技术参考。
木醋杆菌Gluconacetobacter xylinus, 购于微生物菌种保藏中心, 保存于-80 ℃冰箱。浸米水, 取自浙江塔牌绍兴酒有限公司, 经沉降、200目(75 μ m)滤布过滤后, 滤液用于配制BC发酵培养基。葡萄糖、果糖、蔗糖、麦芽糖、甘露糖、Na2HPO4、(NH4)2SO4、MgSO4等均为分析纯, 购自国药集团化学试剂有限公司; 蛋白胨、酵母浸提物, 购自OXIOID。
UV-1800型紫外可见分光光度计, 日本岛津公司; WYA-Z自动阿贝折射仪, 上海仪电科学仪器有限公司; 高压蒸汽灭菌锅, 北京发恩科贸有限公司; 生化培养箱, 上海博讯实业有限公司; 超低温冰箱, 三洋电机国际贸易有限公司; Agilent1200高效液相色谱, 美国安捷伦公司; Agilent7890气相色谱, 美国安捷伦公司; TA.XT Plus型质构仪, 英国Stable Micro Systems; NTS傅里叶变换红外光谱仪, 美国Perkin-Elmer有限公司; D/Max-2550pc型X-射线衍射仪, 日本Rigagu公司; H-7650扫描电镜, HITACHI公司。
种子培养基, 参考HS培养基[14], 各组分(g· L-1)如下:蔗糖20, 酵母浸提物3, 蛋白胨3, Na2HPO4· 12H2O 2.7, 柠檬酸1.15, 用蒸馏水补足至1.0 L。自然pH, 115 ℃灭菌15 min。接种后于30 ℃静置培养3~4 d。
以浸米水为原料的发酵培养基, 参照HS培养基[14], 在浸米水中添加不同碳源、氮源, 于300 mL烧杯中装120 mL培养基, 115 ℃灭菌15 min。接种量(体积分数)3.0%~5.0%, 30 ℃静置培养7~10 d。根据BC产量确定最适碳源和氮源及其最适添加量。
1.4.1 BC产量
发酵结束后, 取出BC, 用水冲洗几次除去表面培养基和杂质, 再将BC浸泡于0.1 mol· L-1的NaOH溶液中, 80 ℃水浴加热20 min, 然后用蒸馏水多次浸泡冲洗, 直至用pH试纸轻压膜测pH值为中性, 去除BC膜中的菌体和残留培养基。105 ℃干燥至质量恒定, BC产率用单位体积培养基中的BC干质量表示(g· L-1)。
1.4.2 培养基理化指标
可溶性固形物含量[白利度(Birx), %]用WYA-Z自动阿贝折射仪测定[15], 总蛋白含量采用考马斯亮蓝染色法测定[16]。葡萄糖、蔗糖、果糖含量采用高效液相色谱检测, 检测条件:Aminex HPX-87H色谱柱(300 mm× 7.8 mm, 9 μ m), 0.005 mol· L-1 H2SO4溶液, 流速0.6 mL· min-1, 柱温40 ℃, 进样量10 μ L, 示差折光检测器。乳酸采用高效液相色谱检测, 检测条件:C18色谱柱(4.6 mm× 250 mm, 5 μ m), 柱温30 ℃, 流动相A为甲醇, 流动相B为磷酸二氢钾水溶液(0.02 mol· L-1, pH值2.4); 梯度洗脱:0 min, 95%(体积分数, 下同)B, 5% A; 25 min, 15% B, 85% A; 35 min, 95% B, 5%A; 45 min, 95% B, 5% A; 流速 1.0 mL· min-1, 紫外检测波长210 nm。乙酸和乙醇采用气相色谱检测, 检测条件:毛细管柱色谱柱(30 m× 0.32 mm); 程序升温:初始柱温45 ℃, 保留时间2 min, 升温速率3 ℃· min-1, 终止温度150 ℃, 保留时间10 min; 气化室温度220 ℃, 载气为高纯氮气, 载气流速1 mL· min-1; 火焰离子化检测仪(FID)检测器, 检测器温度220 ℃, H2流速30 mL· min-1, 分流比50∶ 1。
1.4.3 BC含水量和持水力
将清洗过的BC切成3 cm× 3 cm的方块, 在去离子水中浸泡2 h, 称其质量, 然后将BC用3层滤纸包裹, 放入离心管中, 6 000 r· min-1离心20 min, 将离心后的BC于105 ℃烘干, 再次称其质量。分别计算含水量和持水力[7]。
1.4.4 BC硬度
将清洗过的BC切成3 cm× 3 cm的方块, 采用质构仪测定BC硬度, 用探头(P/0.5型)下降过程中的最大压力(N)表征。
1.4.5 BC微结构
将清洗、干燥后的直径0.5 cm圆片状BC固定于样品台上, 经过喷金处理后, 利用扫描电镜观察BC微结构。
1.4.6 红外光谱扫描
将干燥后的BC磨成粉, 过80目(178 μ m)筛。将过筛后的BC粉与干燥KBr(质量比约为80∶ 1)在玛瑙研钵中混合均匀研细, 用压片器(压力项设置为2.0 kg)压成透明薄片, 然后将薄片放入傅里叶红外光谱仪中进行测定(量程为400~4 000 cm-1)。
1.4.7 X-射线衍射光谱分析
将干燥后的BC磨成粉, 过100目(150 μ m)筛后进行X-射线衍射分析。测试条件:Cu靶, Kα 射线, λ =1.54 Å , X光管电压为40 kV, 电流为40 mA, 扫描范围2θ =8.0° ~40.0° , 扫描步长为0.033° 。用MDI Jade 9.0拟合峰面积, 计算结晶度指数(CrI)[8]。
所有试验数据均重复测定3次, 取平均值。采用Excel 2010对数据进行整理。利用IBM SPSS 21.0对数据进行偏相关性分析, 并计算偏相关系数r:|r|≥ 0.8表示显著相关, 0.5≤ |r|< 0.8表示相关性较高, |r|≤ 0.5表示相关性低。
如表1所示, 浸米水和椰子水的pH值, 以及乳酸和乙醇含量相差不大, 但浸米水中乙酸、可溶性固形物、葡萄糖和总蛋白含量均显著(P< 0.05)低于椰子水, 且在浸米水中未检出果糖和蔗糖。由此可推测, 糖类、蛋白质和乙酸含量低是导致以浸米水为原料生产BC产量低的主要原因。
| 表1 浸米水与椰子水的理化指标比较 Table 1 Comparison of some physicochemical parameters of rice milk and natually fermented coconut water |
根据表1中浸米水和椰子水的组分差异, 以及前期关于小分子酸和醇对BC产量影响的研究[17], 对发酵培养基中不同组分和BC产量进行偏相关分析。从表2可以看出, 乙酸、葡萄糖、果糖、蔗糖、可溶性固形物和总蛋白含量与BC产量之间呈极显著(P< 0.01)正相关(|r|> 0.8), 乳酸含量与BC产量相关性较高但不显著(0.5< |r|< 0.8), 而乙醇含量与BC产量的相关性低(|r|< 0.5)。不同组分之间的相关性差异较大, 乙酸含量、葡萄糖含量、果糖含量、蔗糖含量、可溶性固形物含量相互间呈极显著(P< 0.01)正相关(|r|> 0.8), 而其他组分的相关性不高(|r|< 0.8)。
| 表2 培养基理化指标之间及其与BC产量的偏相关系数(r) Table 2 Partial correlation coefficients (r) within different indexes and BC yield |
2.3.1 不同碳源对BC产量的影响
如图1所示, BC产量随着碳源浓度的增加逐渐升高, 但增速逐渐减小。以果糖为碳源时BC产量最高, 其次是葡萄糖, 再次为蔗糖, 而以甘露糖和麦芽糖为碳源时BC产量最低。当果糖和葡萄糖添加量为35.0 g· L-1时, BC产量最高, 且两者无显著差异。以蔗糖为碳源, 当添加量为30.0 g· L-1时, BC产量最大, 但低于以葡萄糖为碳源时的BC产量。果糖、葡萄糖和蔗糖均直接影响可溶性固形物含量, 它们均可作为发酵培养基中G. xylinus发酵BC的外源碳源, 这与表2相关性分析的结果一致。综合考虑BC产量和原料成本, 选择葡萄糖作为以浸米水为原料生产BC的碳源, 添加量为35.0 g· L-1。
2.3.2 不同氮源对BC产量的影响
从图2-A可以看出, 有机氮源(蛋白胨和酵母浸提物)比无机氮源[(NH4)2SO4和(NH4)2HPO4]更适于BC生产, 且添加蛋白胨和酵母浸提物条件下的BC产量相差不大。
蛋白胨和酵母浸提物中含有不同种类的多肽、维生素、氨基酸和生长因子, 两者混合添加可为菌体生长和BC生产提供更全面的营养。如图2-B所示, 将蛋白胨和酵母浸提物以质量比1∶ 1混合添加时, BC产量随着添加量的增加先逐渐增加后趋于平稳, 最大产量(2.3 g· L-1)高于单独添加蛋白胨或酵母浸提物条件下的BC产量, 最适添加量为蛋白胨和酵母浸提物各3.0 g· L-1。
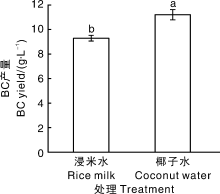
结合前期研究, 在浸米水中按照最适量添加碳源、氮源, 以及对BC生产具有显著促进作用的增效因子(2.0 g· L-1乙酸和20.0 g· L-1乙醇)[17], 在此条件下, BC产量达到9.3 g· L-1(图3), 虽然与工业生产中以椰子水为原料生产BC的产量相比仍有显著(P< 0.05)差异, 但已较为接近。
2.4.1 物理性质
BC是具有纳米孔径微结构的亲水性材料, 水分子会被截留在孔隙中, 因此会表现出一定的含水量和持水力[18, 19]。经过培养基组分优化后, 以浸米水为原料生产的BC的常规物理性质如表3所示。可以看出, 以浸米水为原料生产的BC的含水量和持水力略低于以椰子水为原料生产的BC, 但硬度略高。方差分析结果显示, 两者各指标均无显著差异。
| 表3 以浸米水和椰子水为原料生产的BC的物理性质比较 Table 3 Physical characteristics comparison of BCs produced from rice milk and coconut water |
2.4.2 微结构
以浸米水为原料生产的BC的微结构如图4-A所示, BC基本组成单元为200 nm左右的纤维束, 纤维束无规则地相互缠绕, 交织形成网状结构, 逐渐积累形成BC凝胶膜, 与工业生产中以椰子水为原料生产的BC的微结构相似(图4-B)。但是, 以浸米水为原料生产的BC中微纤维排列更紧密, 孔隙更细小, 与表3中含水量、持水力和硬度的差异变化一致。
 | 图4 以浸米水(A)和椰子水(B)为原料生产的BC的微结构Fig.4 Micro-structure of BCs produced from rice milk (A) and coconut water (B) |
2.4.3 红外光谱
以浸米水为原料生产的BC的红外光谱如图5-A所示, 与以椰子水为原料生产的BC的红外光谱(图5-B)一致, 表明两者的化学组成基本相同。样品在3 349 cm-1附近有一个较强的吸收峰, 反映了O— H键的伸缩振动; 在2 918 cm-1处有较弱的吸收峰, 反映了CH2的不对称振动或CH的伸缩振动, 是糖类物质的特征吸收峰; 在1 643 cm-1处的吸收峰反映了— C=O的伸缩振动; 在1 420 cm-1处的吸收峰反映了O— H键在平面内的变形振动; 在1 056、1 108、1 157 cm-1的峰分别反映了β 构型葡聚糖间的糖苷键和分子内缩醛的C— O键伸缩振动, 以及伯醇、仲醇中C— O键的伸缩振动, 是β 构型葡聚糖的特征吸收峰[19, 20]。
 | 图5 以浸米水(A)和椰子水(B)为原料生产的BC的傅里叶红外光谱图Fig.5 Infrared Fourier transform spectrograms of BCs produced from rice milk (A) and coconut water (B) media |
2.4.4 X-射线衍射图谱
如图6所示, 以浸米水和椰子水为原料生产的BC的X-射线衍射图谱中衍射峰的位置和形状相同:在衍射角2θ 为14.5° 和22.7° 处有2个比较强的衍射峰, 在16.8° 处有一个较弱的衍射峰, 表明2种原料生产的BC均属于I型纤维素[21]。利用MDI Jade计算2θ 为14.5° 、16.8° 和22.7° 处3个衍射峰的晶面指数, 分别为(100)、(010)和(110), 表明G. xylinus以浸米水和椰子水为原料生产的BC均属于Iα 型纤维素[21]。以浸米水和椰子水为原料生产的BC的结晶度相差不大, 分别为82.7%和84.6%。
本研究表明, 浸米水中对BC产量有显著影响的因素为葡萄糖、果糖、蔗糖、乙酸、可溶性固形物和总蛋白含量。乙醇虽然可以大幅提高BC产量[17], 但与BC产量相关性很低(|r|< 0.5), 间接表明乙醇并不直接参与BC合成。Naritomi等[22]和Zhong等[23]的研究也表明, 乙醇主要用于提供能量或被转化为乙酸用于BC合成。偏相关系数是在排除了其他变量的影响下两变量间的相关系数, 若2个变量的相关性很高, 表明它们属于同类变量。因此, 乙酸与果糖、葡萄糖和蔗糖均可作为BC合成的碳源, 这与已报道的结果一致[24]。但是, 乙酸添加过多会使培养基pH值过低, 菌体活性受到抑制, 进而导致BC产量下降[25], 因此, 应将乙酸含量视为独立影响因素进行考虑。
BC微结构孔隙大小随纤维束的数量多少和直径粗细而不同, 决定了BC含水量和持水力的差异[18, 19]。以浸米水和椰子水为原料生产的BC的微结构和结晶度略有差异, 但其化学组成相同, 均为Iα 型纤维素, 与已有研究一致[21, 26]。影响BC微结构和结晶度的因素主要为菌种、培养基组分和发酵条件[3, 27]。静置培养时BC通常为光滑片状, 振荡培养时BC为絮状或球状, 而后者的结晶度和机械强度均低于前者[1]。Bi等[28]发现, 在相同培养条件下, 不同发酵菌株所产的BC形态不同, 导致其结晶度出现差异。由此推测, 本研究中BC微结构和结晶度的差异是由原料中的组分差异造成的。这也表明, 可通过改变培养基组分来调控BC的微结构和结晶度, 进而调控BC的物化性质。Dayal等[3]的研究表明, 向BC发酵培养基中添加果胶和明胶均可提高BC的压缩模量和弹性模量, 而添加羧甲基纤维素钠和果胶则会降低BC的结晶度。BC的性质决定了其应用方向, 可根据用途不同, 在BC发酵过程中或发酵结束之后添加适量调节剂对BC的结构进行修饰, 从而改变其性质, 以用于电子、医药等行业, 及用作抗菌包装等新材料[1, 8, 29]。
目前, 生产原料不足严重制约了我国BC产业的发展。本研究中, 虽然以浸米水为原料生产BC的产量低于以椰子水为原料生产BC的产量, 但我国浸米水量大而集中, 因此仍具有一定的工业化推广前景。以浸米水为原料生产BC, 不仅可提高我国BC产量, 满足不断增加的需求, 还可降低BC生产成本, 解决浸米水无法得到有效利用的问题。鉴于不同领域的材料对BC的性质要求差异较大, 后期还需要深入研究以浸米水为原料生产的BC的晶型结构、热性能、拉伸性等性能, 探究影响BC结构和物化性质的因素及其调控方式。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|