作者简介:张雅莉(1966—),女,山东曹县人,实验师,主要从事小麦遗传育种研究。E-mail: 923978923@qq.com
大赖草对赤霉病具有较好的抗性,将大赖草赤霉病抗性基因转入普通小麦,对拓宽小麦赤霉病抗性基础有重要意义。本研究在获得抗赤霉病普通小麦-大赖草异附加系基础上,采用1 200 R60Co-γ射线处理小麦-大赖草二体附加系DA7Lr花粉,授予已去雄的普通小麦中国春,对其后代(M1)种子根尖细胞有丝分裂中期染色体进行GISH分析,获得了1株具有1条普通小麦-大赖草易位染色体的植株,让其自交,对自交后代中具有2条易位染色体植株的花粉母细胞减数分裂中期Ⅰ进行观察,发现2条易位染色体形成了稳定的环状二价体,表明该植株为纯合体。利用顺序GISH-双色FISH分析,结合C-分带、小麦D基因组专化探针Oligo-pAs1-2和B基因组专化探针Oligo-pSc119.2-2,进一步鉴定出该普通小麦-大赖草易位系为T3AS·3AL-7Lr#1S,且筛选出了可追踪该易位系的3个EST-STS分子标记BE591127、BQ168298和BE591737。该易位系的育成为小麦赤霉病遗传改良提供了新种质。
Leymus racemosus is highly resistant to wheat scab (Fusarum head blight, FHB). The transfer of scab resistant gene from L. racemosus to Triticum aestivum is of great significance for broadening the base of wheat resistance. In the present study, the pollen of T. aestivum-L. racemosus disomic addition line DA7Lr with scab resistance was irradiated by60Co-γ-rays 1 200 R (100 R·min-1) prior to pollinating to emasculated T. aestivum cv. Chinese Spring. One plant with a translocated chromosome was detected in the M1 by GISH. The plant with one translocation chromosome was self-pollinated, and at meiotic metaphase Ⅰ its progenies with two translocation chromosomes were analyzed for chromosome pairing behavior in their pollen mother cells (PMCs). One ring bivalent was observed, indicating that the plant with two translocation chromosomes was one translocation homozygote. C-banding and sequential GISH/FISH analysis, using Oligo-pAs1-2 and Oligo-pSc119.2-2 as probe, translocation line T3AS·3AL-7Lr#1S was confirmed. Three molecular markers of EST-STS such as BE591127, BQ168298 and BE591737 were screened, and these markers can be used to track the translocation line. The translocation line had good resistance to wheat scab and feasibility to be used as a new germplasm in wheat breeding resistant to scab disease.
赤霉病是由禾谷类镰刀菌(Gibberellazeae(Schw.) Petch)引起的小麦灾难性病害, 被称为小麦“ 癌症之王” [1]。2000年前赤霉病是我国长江中下游冬麦区、东北春麦区和华南冬麦区的主要病害。随着全球气候变暖、栽培耕作制度的改变, 赤霉病发生越来越频繁, 发生区域不断扩大, 范围越来越广。近些年, 在北方黄淮麦区和关中麦区, 赤霉病屡有发生, 已上升为主要病害, 成为影响该区域小麦产量的重要因素。与此同时, 由禾谷类镰刀菌产生的脱氧雪腐镰刀菌烯醇真菌毒素(deoxynivalenol, DON), 直接在小麦籽粒中积累进入食物链, 严重威胁人类健康[2, 3, 4]。培育抗病品种可以抑制赤霉病菌侵染, 降低毒素在籽粒中的累积, 是一条经济有效的途径。但赤霉病抗源匮乏, 遗传基础狭窄, 致使培育高产抗病品种的选育进展缓慢, 已成为一个世界性难题[5]。而化学药剂防治既污染环境又会导致禾谷类镰刀菌产生抗药性, 对感病品种也难以达到理想防治效果。因此, 拓宽赤霉病种质资源, 加快抗病新品种选育是一条长期、安全和可靠的策略。
大赖草(Leymus racemosus)是一种与小麦亲缘关系较远的多年生植物, 具有耐盐、抗旱、抗多种病害等优良特性[6, 7], 尤其高抗赤霉病, 是一种具有潜在应用价值的基因资源。南京农业大学1983年将大赖草的赤霉病抗性基因导入普通小麦, 选育出具有较高赤霉病抗性的普通小麦-大赖草异附加系AddLr.2” 、AddLr.7” 和AddLr.14” [8]; Wang等[9]证明7Lr#1S上存在抗赤霉病的主效基因; Qi等[10]把7Lr#1S携带的抗赤霉病基因Fhb3定位在该染色体的近端部; 并在此基础上创制了一批携带大赖草赤霉病抗病基因的小麦大赖草易位系[11, 12, 13], 在生产上进行了初步尝试, 表现出良好的效果。
本研究采用电离辐射处理附加系DA7Lr的花粉, 诱导易位系。利用染色体C-分带、荧光原位杂交、分子标记技术和赤霉病抗性鉴定等技术, 对抗赤霉病的普通小麦-大赖草异附加系DA7Lr成熟花粉辐射的后代进行鉴定, 筛选出抗赤霉病的普通小麦-大赖草易位系, 为小麦抗赤霉病育种提供新的种质。
利用60Co-γ 射线(剂量1 200 Rad, 剂量率100 Rad· min-1)照射普通小麦-大赖草二体异附加系DA7Lr开花期麦穗, 取其辐射花粉与普通小麦中国春杂交, 让其后代种子自交, 鉴定出纯合易位系。抗赤霉病对照品种苏麦3号和感赤霉病品种中国春由河南科技大学农学院小麦遗传育种研究室引进保存。
1.2.1 根尖细胞有丝分裂中期
将小麦种子放入垫有湿滤纸的培养皿内发芽(23 ℃), 待根长至1.0~2.0 cm时, 剪取1~2条种子根在冰水中处理20~24 h。用无水乙醇冰醋酸混合液(体积比3∶ 1)固定, 4 ℃冰箱中保存3 d后于45%醋酸中进行根尖压片, 相差显微镜下染色体观察, 放入-70 ℃冰箱或液氮中冷冻揭去盖玻片, 脱水备用。
1.2.2 花粉母细胞减数分裂中期Ⅰ
挑取处于减数分裂中期Ⅰ 的花药, 用上述固定液固定, 按根尖细胞有丝分裂中期制片方法压片。
参照Gill等[14]的方法进行染色体C-分带。荧光原位杂交参照Mukai等[15]的方法稍加修改进行。参照Zhang等[16]的方法顺次原位杂交, 首先以荧光素Fluorescein-l2-dUTP标记的大赖草基因组DNA为探针进行基因组原位杂交, 通过SPOT CCD(charge coupled device)获取FISH图像, 然后将信号洗脱, 再以红色荧光标记的B组专化探针Oligo-pSc119.2-2(其寡核苷酸重复序列为6-FAM-5'-TTCCA CGATT GACGATTCCG GGGGT GCGTTTACGT GTCCG TCGTC-3')和绿色荧光标记的D组专化探针Oligo-pAs1-2(其寡核苷酸重复序列为Tamra-5'-CATTT CATCC ACATAGCATG TGCAA GAAAT TTGAGAGGGT TACGG CAAAA ACTGGAT-3')进行双色荧光原位杂交, 用DAPI(4’ , 6-diamidino-2-phenylindole, DAPI)染色。SPOT CCD(charge coupled device)获取图像。图像结果参照Tang等[17]的标准FISH图谱进行分析。实验过程中采用的绿色荧光素和两种专化探针分别由上海英俊生物科技有限公司提供和合成。
植物DNA提取参照Sharp等[18]的SDS法。采用10 μ L PCR反应体系, 模板DNA 20 ng、1.5 mmol L-1 MgCl2、1× buffer、200 mmol L-1 dNTP、终浓度各为0.2 μ mol L-1的左右引物、0.5 U Taq DNA聚合酶。PCR反应程序为94 ℃预变性3 min; 94 ℃变性30 s, 50~60 ℃退火40 s, 72 ℃延伸50 s, 34个循环; 72 ℃延伸10 min, 4 ℃保存。扩增产物经8%非变性聚丙烯酰胺凝胶电泳, 硝酸银染色后照相分析。
抗性鉴定在河南科技大学开元校区农场进行, 试验按照随机区组设计。采用王裕中等[19]的单花滴注法接种禾谷镰刀菌(菌种由河南科技大学林学院植物病理系徐建强博士提供), 接种后早晚2次喷雾, 保证禾谷镰刀菌的发病湿度。2015— 2017年连续3年均使用编号为LHLY-2高强毒菌株分生孢子悬浮液。每小区接种10穗, 接种21 d后, 调查接种穗的发病小穗数和总小穗数, 计算病小穗率。调查结果采用SPSS软件进行统计分析。
利用电离辐射处理普通小麦大赖草异附加系DA7Lr开花期的穗子, 取其辐射花粉授予已去雄的普通小麦中国春, 对其辐射后代种子, 进行根尖细胞染色体荧光原位杂交(FISH)分析, 结果发现一株编号为NGH-03单株具有1条普通小麦-大赖草易位染色体, 从自交后代种子中得到了1株含有2条易位染色体的单株, 根尖细胞有丝分裂中期染色体制片, 相差显微镜下观察。
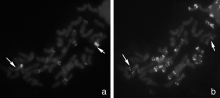
以绿色荧光标记大赖草基因组DNA和以红色荧光标记的小麦B组专化探针Oligo-pSc119.2-2作为探针, 对分裂相较好的NGH-03纯合种子根尖染色体制片进行双色荧光原位杂交(GISH-FISH)。结果显示:在荧光显微镜下, 可以观察到易位染色体的大赖草片段端部处有很强的绿色荧光杂交信号, 易位染色体的小麦片段未出现红色Oligo-pSc119.2-2杂交信号(图1-a)。该易位染色体为大赖草7Lr短臂端部片段与小麦某染色体的部分片段发生的顶端易位。
为了进一步确定易位染色体中小麦染色体片段的身份, 将双色杂交信号洗脱, 再以绿色荧光标记的小麦D组专化探针Oligo-pAs1-2进行原位杂交。结果显示:在易位小麦染色体近着丝粒处有两个明显的绿色Oligo-pAs1-2杂交位点(图1-b)。参照Tang等[17]的原位杂交图谱, 发现D组的7对染色体, 在其长臂和短臂的端部和近端部均有较强的杂交信号, 因此可排除D组染色体。B组染色体只有3B染色体的长臂、6B染色体的短臂以及7B染色体的两臂端部和近端部有杂交信号, 这3对染色体也可排除。A组染色体中, 1A和2A短臂的端部, 4A染色体长臂的端部有明显的杂交信号, 7A染色体两臂端部有弱的杂交信号; 1A和5A染色体长臂的近中部有明显杂交信号, 只有3A染色体短臂在近着丝粒处有明显的杂交信号。C-分带结果发现易位的小麦染色体臂上近着丝粒处有2个较清晰的点状带纹, 着丝粒处C带不强, 也符合3A染色体的C带特点(图2), 因此可推测易位涉及的小麦染色体为3A。
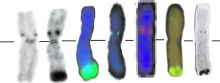
对其花粉母细胞减数分裂中期Ⅰ 染色体制片进行DAPI染色, 荧光显微镜下镜检分析其染色体构型, 发现其易位染色体正常配对, 形成了稳定的环状二价体(图3), 该易位系命名为T3AS· 3AL-7Lr#1S。
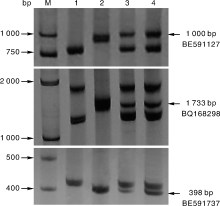
根据小麦第7部分同源群不同区段的EST序列合成了81对EST-STS引物。其中有3对引物发现在大赖草、DA7Lr和易位系T3AS· 3AL-7Lr#1S上有特异扩增, 它们是BE591127、BQ168298和BE591737, 均定位在第7同源群的7DS、7AS和7BS上, 扩增出的3条特异条带, 大小分别约1 000、1 733和398 bp(图4)。因此, 可以利用这3对特异引物追踪大赖草染色体片段, 鉴定含有该大赖草染色体片段的易位染色体。
经过连续3年的赤霉病接种鉴定, 结果表明, 易位系T3AS· 3AL-7Lr#1S的病小穗率显著低于感病亲本中国春和感病对照绵阳85-45, 但稍高于抗病对照苏麦3号(表1、图5), 表现出了较好的赤霉病抗性。
| 表1 T3AS· 3AL-7Lr#1S的赤霉病病小穗率 Table 1 Evaluation of scab resistance of T3AS· 3AL-7Lr#1S |
赤霉病频繁发生已成为我国小麦主产区的主要病害, 对小麦产量带来严重影响, 产生的真菌毒素脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON)对小麦食品安全构成了严重威胁, 长期采用化学药剂防治不仅引起病害的抗药性, 也会造成环境污染。培育抗赤霉病品种是防治赤霉病经济有效的途径, 但由于抗赤霉病的亲本资源匮乏, 遗传基础狭窄, 抗赤霉病品种选育陷入了瓶颈。2017年国审通过的20个半冬性小麦品种及河南省审定通过的27个小麦品种全部高感赤霉病, 致使我国小麦主产区黄淮麦区存在巨大的安全隐患。因此, 迫切需要拓宽小麦育种的赤霉病种质抗源。
尽管苏麦3号小麦是目前世界公认的最好的赤霉病抗性种质[20], 但由于其杂交后代抗性选择效果差, 农艺综合性状不够理想, 实现高产与抗病的有机结合比较困难, 很难发挥其应有的作用, 小麦品种间抗源的选择难以有突破性进展。小麦野生近缘植物抗赤霉病性给抗病育种抗源选择提供了新的思路。大赖草作为普通小麦的近缘野生植物, 高抗小麦赤霉病, 早已引起研究者的高度重视。自1983年, 农业部作物细胞遗传重点实验室(南京农业大学)选育出高抗赤霉病的普通小麦大赖草异附加系以来, 遗传育种工作者采用电离辐射、杀配子染色体诱导等方法创造了一批普通小麦-大赖草易位系, 拓宽了抗赤霉病的新种质, 起到了良好的示范作用。本研究通过电离辐射小麦-大赖草二体附加系DA7Lr花粉创造出的普通小麦-大赖草易位系T3AS· 3AL-7Lr#1S, 经大田鉴定高抗小麦赤霉病, 可以作为赤霉病抗性育种的中间材料。
采用电离辐射将外源有益基因导入普通小麦是创造小麦新种质的常用方法[21, 22], 在小麦种质创新过程中, 发挥了非常重要的角色。但由于电离辐射造成染色体断裂重接随机性强, 产生的易位染色体补偿性往往较差, 直接利用尚存在一定困难, 因此, 创造携带外源有益基因的补偿性易位和小片段易位, 尤其是中间插入易位已成为研究者追求的目标。本研究采用电离辐射的方法创造普通小麦大赖草易位系, 并利用C-分带、GISH-FISH双色荧光原位杂交技术, 鉴定出了易位系T3AS· 3AL-7Lr#1S, 并筛选出了3个在易位系T3AS· 3AL-7Lr#1S上有特异扩增的EST-STS多态性标记BE591127、BQ168298和BE591737, 可有效追踪大赖草染色体片段。所获易位系T3AS· 3AL-7Lr#1S对赤霉病表现了较好的抗性, 但由于其遗传背景是小麦中国春, 农艺性状较差, 植株较高, 达101 cm; 生育期较长(236 d), 比对照品种偃展4110晚熟7 d以上, 千粒重较低(29.5 g), 穗子顶端有秃尖, 小穗基部小花有缺位现象, 很难直接利用, 因此, 仍需要进一步回交改良。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|