作者简介:何海燕(1981—),女,浙江江山人,硕士,助理研究员,主要从事水稻抗病育种研究。E-mail: hehaiyan@zaas.ac.cn
为了明确浙江省部分水稻主栽品种和中国稻瘟菌生理小种鉴别品种中稻瘟病抗性基因分布情况,本研究采用5个基于稻瘟病抗感等位基因序列设计的功能性分子标记,对40份浙江省水稻主栽品种和6份稻瘟菌鉴别品种中 Pit、 Pib、 Pii/Pi3 /Pi5、 Pia、 Pi1等5个稻瘟病抗性基因进行了分子检测。结果发现,这5个抗性基因在浙江省栽培品种中分布频率不同,其中 Pib基因分布最广,占63.04%;其次是 Pia,占58.70%;携带 Pii/Pi3 /Pi5和 Pit抗性基因的材料较少,分别为21.74%和10.87%。同时用2015—2017年田间采集到的141个稻瘟菌菌株检测46个水稻品种苗瘟抗性水平,结果显示,其中仅15个品种的抗性频率在70%以上,大部分品种携带其中1~2个抗性基因。聚合了多个抗性基因的品种抗性水平相对较高。
In order to clarify the distribution of blast resistance genes in some rice cultivars and blast-resistant cultivars in Zhejiang Province, five functional molecular markers based on blast resistance allele sequences were used to detect Pit, Pib, Pii/Pi3 /Pi5, Pia and Pi1 resistance genes in 40 main rice varieties in Zhejiang Province and 6 Chinese rice blast identification varieties. The results showed that the distribution frequencies of the five resistance genes were different, Pib gene was most widely distributed, accounting for 63.04%, followed by Pia, accounting for 58.70%, Pii/Pi3 /Pi5 and Pit resistance genes were less, accounting for 21.74% and 10.87% respectively. At the same time, the resistance level of 46 rice varieties to Magnaporthe grisea was detected by 141 strains collected in the field from 2015 to 2017. The results showed that the resistance frequency of 15 varieties was more than 70%. Most of the varieties carried one or two resistance genes. The resistance level of varieties with multiple resistance genes was relatively higher.
由稻瘟病菌(Magnaporthe grisea)引起的稻瘟病是水稻三大病害之一, 其暴发严重影响水稻的产量及品质。我国20世纪80— 90年代以来流行年份发病面积超过600万hm2, 21世纪以来我国稻瘟病每年发病面积在480万hm2左右。2014年稻瘟病发病严重, 浙江省水稻种植区域稻瘟病单位发生面积达到2.33万hm2, 损失超过350 kg· hm-2[1]。除了特殊的气候因素、稻瘟病预防措施不到位外, 主栽品种抗性下降也是稻瘟病重发的重要原因, 浙江、江苏等地都出现了稻瘟菌优势种群的变化, 导致原先抗病的品种突然感病[2]。因此选育抗病品种, 并轮换种植是降低稻瘟病流行风险的重要举措。
目前, 水稻育种家致力于培育抗性强及抗谱广的水稻品种, 一些已经被定位和克隆的抗性基因, 比如Pi9、Pi2、Pigm、Pi5、Pia等已经在生产上广泛运用。然而传统的杂交、回交等育种技术周期长, 筛选困难, 给育种带来一些阻碍。一些与稻瘟病抗性基因紧密连锁或者源于抗性基因本身序列开发的特异性分子标记, 为快速、准确、系统地鉴定水稻品种抗瘟基因型, 以及高效开展抗稻瘟病基因聚合育种带来了新的契机。Wang等[3]利用已克隆基因Pita的功能性分子标记检测水稻品种中Pita基因的携带情况, 准确有效而且效率颇高。华丽霞等[4]利用GenBank数据库获取Pi9、Pi2、Pizt全基因组序列, 并且利用Seqman软件比对日本晴基因组上等位感病基因序列, 开发了Pi9、Pi2、Pizt抗性基因分子标记, 对101份水稻保持系、恢复系及常规稻品种进行了基因筛查。
孙国昌等[5]利用我国主要稻区的155个稻瘟菌株对13个粳稻品种(已知携带单抗性基因)的抗性水平进行了测定, 发现对浙江省菌株的抗性情况表现为Pii> Pib> Pit> Pia, 菌株毒力频率分别为35.0%、48.1%、58.9%、88.0%。而20世纪80— 90年代, 不少基因的抗性发生了很大的变化, 本研究利用Pit、Pib、Pii/Pi3/Pi5、Pia、Pi1五个稻瘟病抗性基因功能性分子标记, 对浙江省46个水稻主栽品种, 包括籼型三系杂交稻、粳型三系杂交稻、籼型两系杂交稻、粳型常规稻、籼型常规稻等进行了抗瘟基因检测, 并且对这些品种进行了稻瘟菌接种、抗苗瘟水平分析, 旨在摸清浙江省水稻栽培品种中5个抗性基因携带情况及基因型, 初步探讨水稻抗性基因基因型和抗瘟水平的相关性, 为浙江省稻区抗病育种和合理布局提供依据。
本研究所用的水稻品种包括阳性对照材料丽江新团黑谷单基因系品种7个, 为Pit、Pib、Pii、Pi3、Pi5、Pia、Pi1基因供体品种IRBt-K59、IRBLb-B、IRBLi-F5、IRBL3-CP4、IRBL5-M、IRBLa-A和IRBL1-CL(由粮食作物“ 基因对基因” 病害农业农村部行业专项提供); 阴性对照材料丽江新团黑谷1份, 浙江省水稻主栽品种40份, 稻瘟菌鉴别品种6份, 由浙江省农业科学院植物与微生物研究所提供, 如表1所示。
| 表1 供试水稻材料 Table 1 Rice cultivars used in this study |
将水稻种子置于28 ℃浸种2 d后, 32 ℃催芽48 h, 选取发芽良好的种子穴播于盛有肥沃土壤的育苗盆内, 穴间距为5 cm左右, 每穴播种发芽良好的种子10粒左右, 每盆中分别设感病对照1份, 各重复内品种采用随机排列; 2叶期定苗酌施氮肥, 促苗以利于做接种试验。在温室中培养14 d后, 进行样品采集和接种。
1.2.1 菌株来源、活化、繁殖和产孢
本试验采用2016-42-1、2016-36-2、2017-41-3等141个菌株, 所有菌株分离自2015— 2017年浙江各地采集的稻瘟菌标样。菌株活化后接种于CM固体培养基上, 28 ℃, 12 h光暗交替培养10 d后, 加入无菌水洗刷孢子, 用血球计数板将孢子悬浮液浓度调节至约2× 105 mL-1的浓度, 作为苗期喷雾的接种体。
1.2.2 水稻喷雾接种和发病调查
水稻生长14 d左右, 即在幼苗三叶一心期, 在孢子悬浮液中加入0.5%~0.8%的明胶进行喷雾接种, 每100株苗约30 mL; 于26 ℃下黑暗保湿24 h, 然后移至28 ℃的高湿(用喷雾器进行不定时喷雾)环境下培育。
接种7 d后参照国际稻瘟病苗瘟调查标准[6]调查发病情况。抗性频率(%)为水稻材料在稻瘟菌接种中表现抗性菌株数与总测定菌株数目之比。
1.2.3 样品采集及DNA提取
每个品种采集1个单株的2 cm长叶片, 放置2 mL离心管(提前放置2~3颗钢珠)中, 用TPS法抽提水稻叶片总DNA。加入100 μ L ddH2O(含RNA酶)溶解, 37 ℃温浴40 min, 然后-20 ℃保存。
1.3.1 基因特异性分子标记
抗性基因Pit等5个抗性基因使用分子标记的引物序列及扩增多态性差异见表2。引物由上海擎科生物技术公司合成。
| 表2 用于PCR反应的分子标记 Table 2 Functional markers used for resistant gene amplification |
1.3.2 基因特异性分子标记的检测
检测采用PCR扩增方法。用20 μ L PCR反应体系, 含1 μ L(40 ng)模板DNA, 0.5 μ L正向引物(10 μ mol· L-1), 0.5 μ L反向引物(10 μ mol· L-1), 10 μ L 2× TSINGKE Master Mix, 8 μ L ddH2O。PCR反应条件:94 ℃预变性2 min; 94 ℃变性30 s, 50~60 ℃退火30 s, 72 ℃延伸1 kb· min-1, 35个循环; 最后72 ℃ 5 min。凝胶电泳拍照记录。
本研究对40个浙江省主栽品种, 6个稻瘟菌鉴别品种, 以及7个含有对应抗性基因的丽江新团黑谷单基因系进行了苗期抗性测定。结果在40个浙江省水稻主栽品种中, 秀水321和浙优12两个品种抗性频率达到80%以上, 占比为5%; Y两优1号、浙粳86等13个品种抗性频率在70%~80%, 占比为32.50%; Y两优689、内五优8015等7个品种抗性频率在60%~70%, 占比为17.50%。5个稻瘟病鉴别品种中, 抗性频率最高的是TTP, 为54.61%; 抗性频率最低的是合江18, 为26.95%。7个丽江黑谷单基因系中, 抗性频率最高的是IRBL1-CL(Pi1)和IRBLt-K59(Pit), 分别为34.75%和32.62%; 抗性频率最低的是IRBLb-B(Pib), 为9.93%。其余几个单基因系的抗性频率为15%~31%。鉴定结果如表3所示。
| 表3 浙江省主栽品种、稻瘟菌鉴别品种和丽江新团黑谷单基因系抗性频率 Table 3 Resistance frequency of main cultivars in Zhejiang, rice blast identification cultivars and LTH monogenic line |
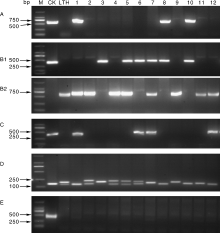
利用已建立的分子鉴别体系对46个浙江省主栽水稻品种和稻瘟病鉴别品种的基因分布情况进行了研究, 获得了部分稻瘟病抗性基因的分布情况(表4)。结果发现在这46个品种中, 有5个品种携带Pit抗病基因, 有29个品种携带Pib抗病基因, 有8个品种携带Pii/Pi3/Pi5抗病基因, 有27个品种携带Pia抗病基因, 有1个品种携带Pi1抗病基因。部分基因抗性分子标记检测结果如图1所示。
| 表4 Pit、Pib、Pii/Pi3/Pi5、Pia和Pi1基因在浙江省主栽品种和稻瘟病抗性品种中的分布及基因型 Table 4 Distribution and genotypes of Pit, Pib, Pii/Pi3/Pi5, Pia and Pi1 in main cultivars in Zhejiang, and rice blast identification cultivars |
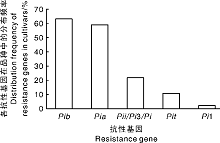
在检测的水稻品种中, 抗性基因Pib和Pia分布频率最高, 分别为63.04%和58.70%; 其次是抗性基因Pii/Pi3/Pi5和Pit, 分别为21.74%和10.87%。检测的浙江省主栽品种都不携带Pi1基因, 仅稻瘟菌鉴别品种TTP携带该基因。各个抗性基因分布频率如图2所示。
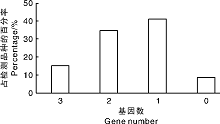
对40个浙江省水稻主栽品种和6个稻瘟菌鉴别品种检出的稻瘟病抗性基因进行数量分析, Ⅱ 优650、春优84、嘉58等7个品种同时携带了3个抗病基因, 占检测品种比率为15.22%; Y两优689、内五优8015和绍糯9714等16个品种同时携带了2个抗病基因(其中1个为稻瘟菌鉴别品种), 占测试品种的34.78%; 有19个品种仅携带了1个抗病基因(其中4个为稻瘟菌鉴别品种), 占测试品种的41.30%; 还有4个品种未携带任何抗病基因(其中1个为稻瘟菌鉴别品种), 其比率为8.70%(图3)。
自20世纪70年代, 中外学者对水稻品种中含有的抗性基因进行分析归类。山崎等[13]发现抗性基因Pia普遍存在于爱知旭等日本品种中, 后来又发现该基因也分布于韩国、中国等东南亚国家水稻品种中, 而且在美国播种的水稻品种中也有发现, 说明该基因分布相当广泛。同时, 山崎等[13]对石狩白毛品种进行抗性分析, 在该品种中发现抗性基因Pii。美国学者Yi等[10]在研究中发现Pi5、Pi3和Pii位于染色体相近位置, 且抗谱比较接近, 推测3个基因等位或连锁紧密。本研究发现, Pi5基因的显形标记适用于其他2个基因, 然而3个分别携带Pi5、Pi3和Pii基因的丽江新团黑谷单基因系材料抗谱并不一致, Pi5基因的抗性频率明显较后两者高, 说明这3个基因在进化历程中分化比较晚, 对稻瘟病菌的抗性却有了明显的差异; 值得做进一步比较分析, 开发能区分3个基因的特异性分子标记。本研究同时分析了46个水稻品种中5个抗性基因位点的携带情况, 发现品种浙粳99和浙优12仅检测到其中1个抗性基因, 抗性频率分别达到了79.43%和81.56%; 说明这两个品种中可能还存在其他抗病基因, 显著提升了品种的抗病水平, 值得进行进一步研究。研究中发现Pib基因在浙江省主栽品种中分布非常广, 72.5%的浙江省主栽品种携带该基因, 然而该基因的抗性频率非常低, 仅9.93%, 说明这个基因对近3年浙江省品种的抗瘟水平的贡献非常小, 有可能是该基因在过去的某些年里发挥过重要的抗瘟作用, 然而近几年稻瘟菌菌株普遍克服了该抗性基因分泌的效应蛋白。这可能也是某些水稻品种抗瘟水平下降的原因, 比如品种宁81, 经检测仅携带该抗性基因, 其抗性频率偏低, 为43.26%。张善磊等[14]利用分子标记对包含167份长江中下游地区粳稻品种(系)在内的200多份粳稻材料中的4个稻瘟病抗性基因进行了分布情况分析, 发现长江中下游材料中有44.31%携带Pib基因。在38份只携带Pib基因的品种(系)中, 33份表现为中感或高感穗颈瘟(感病率为86.84%)。这与本研究结果基本一致。在该研究中, 作者还发现, Pi5基因在东北、华北、长江中下游、西北和西南稻区都有一定数量的分布, 在日韩的粳稻品种中也有不低的分布水平, 说明该基因分布相当广; 30份仅含Pi5单基因的品种中, 19份感病(感病率为63.33%)。这与本研究结果也是基本一致的。
本研究中的5个抗性基因丽江黑谷单基因品系抗性频率都不高(都没有达到40%), 但是本研究中77.5%浙江省品种的抗性水平都超过了50%, 说明抗性基因的聚合显著提高了品种的抗瘟水平, 这也和目前倡导的多基因聚合抗稻瘟病育种的思路相符。浙江省稻区属于籼稻粳稻混栽区, 稻瘟病菌群结构也较复杂[15], 一个抗性品种推广数年常会引起菌群小种结构变化, 导致品种抗性丧失。水稻品种抗稻瘟基因分析是抗病育种和抗病品种合理利用的基础性工作, 目前这项工作仍有待加强[5]。水稻与稻瘟菌长期协同进化过程中形成了两种免疫机制[16], 即稻瘟菌相关分子诱导的抗病反应机制(PAMP-triggered immunity, PTI)和稻瘟菌效应蛋白诱导的抗病反应机制(effector-triggered immunity, ETI)。其中明晰抗稻瘟病基因与其对应的无毒基因是认识ETI免疫机制的关键[17]。目前已经有包括Pi25[18]、Pi35[19]、Pi36[20]和Pi37[21]在内的20多个抗瘟基因被克隆, 也有PWL1[22]、PWL2[23]、AvrPi-ta[24]和AvrPi-zt[25]等10个无毒基因被克隆, 而且不少于4对R基因和Avr基因的互作模式已被阐述[18]。在抗稻瘟育种方面也有更多新的策略可以选择; 比如全基因选择育种和靶基因调控育种。Zhao等[26]利用全基因组关联分析鉴定了5个抗性基因位点, Kang等[27]在其基础上又鉴定了66个稻瘟病抗性位点, 这些都成为全基因组选择育种的基础。将新开发的水稻抗瘟育种技术同常规育种程序科学地结合起来, 发展出一套高效、系统便于育种家利用的技术体系是未来育种的新思路, 然而仍有不少难题有待克服。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|