作者简介:方芳(1994—),女,安徽安庆人,硕士研究生,研究方向为作物学。E-mail: 1208250718@qq.com
高温胁迫影响夏播玉米自交系幼苗生长、田间整齐度和制种产量,探究玉米幼苗期对温度胁迫的响应机制,有利于培育和筛选抗性优良的品种。该试验选取了浙江大学育成的耐热型和热敏感型自交系各2份,45 ℃进行高温胁迫处理,经高温处理后进行叶绿素含量、抗氧化酶活性测定,以及相关基因表达分析。结果表明,经过高温胁迫处理并恢复生长后,与耐热型自交系相比,热敏感型自交系的叶绿素a、b含量、叶绿素a/b值、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、抗坏血酸过氧化物酶(APX)活性、谷胱甘肽还原酶(GR)活性均下降,而脯氨酸含量小幅上升。利用qRT-PCR技术对脯氨酸合成途径的关键酶基因 ZmP5 CS、降解途径的关键酶基因 ZmProDH、热激蛋白基因 ZmHSP70和 ZmHSP90在高温胁迫条件下的表达特性进行了分析,发现 ZmP5 CS、 ZmHSP70和 ZmHSP90明显受热胁迫诱导,并且热敏感型自交系中 ZmP5 CS、 ZmHSP70和 ZmHSP90的表达量均显著低于耐热型自交系,而 ZmProDH的表达量显著高于耐热型自交系,由此说明,高温胁迫过程中脯氨酸的积累、抗氧化酶活性和热激蛋白基因表达的增强是玉米幼苗耐热性形成的响应机制。
High temperature stress affects the growth of maize inbred lines during seedling period and field tidiness as well as seed yield, therefore, exploring the response mechanism of maize seedling stage to temperature stress is conducive to breeding and screening varieties with high resistance. The mechanism was studied through the determination of chlorophyll content, antioxidant enzyme activity and gene expression of two different phenotypes after high temperature stress treatment at 45 ℃. The results showed that chlorophyll a and chlorophyll b content, chlorophyll a/b value, SOD activity, POD activity, CAT activity, APX activity and GR activity in heat sensitive inbred lines decreased dramatically compared with heat resistant lines after high temperature challenging and recovery experiment ,while the proline content increased slightly. The expression of ZmP5 CS and ZmProDH, two key enzyme genes of proline metabolic pathway, and heat shock protein genes ZmHSP70, ZmHSP90 under high temperature stress were analyzed by qRT-PCR. Our result showed that ZmP5 CS, ZmHSP70 and ZmHSP90 were significantly induced by heat stress, and the induction of these genes in heat sensitive inbred lines were mild in comparison with heat resistant inbred lines, while the expression of ZmProDH was significantly higher. These results showed that the accumulation of proline, activity of antioxidant enzymes and expression of heat shock protein genes involved in maize seedlings response to high temperature stress.
玉米(Zea mays L.)是世界上重要的谷类粮食作物之一, 种植面积、总产量和单位面积产量均居谷类作物的首位。我国是世界上主要玉米生产国之一, 播种面积和总产量都居世界第二位[1]。近年来, 随着温室效应加剧, 全球气温不断升高, 极端性气候如夏季高温, 已经成为制约玉米生产的重要因素之一。目前, 不少学者对植物在高温胁迫下的响应机制进行了一系列细胞学、生理学和分子生物学方面的研究。已有研究表明, 植物耐热性与叶片显微结构存在一定相关性。与热敏感品种相比, 耐热型品种叶片上表皮气孔关闭, 下表皮气孔频度高, 气孔体积小且开张度小; 叶片厚, 叶肉组织细胞排列紧密, 无胞间隙, 很少出现质壁分离; 叶脉维管束发达, 特别是木质部导管数多且孔径大, 具有发达的形成层和厚壁组织, 排列紧密[2]。此外, 花器官也是植物开花期对热胁迫最敏感、最易受损伤的器官。宋春英等[3]发现, 高温会使玉米雌穗吐丝困难、吐丝紊乱; 吐丝后的花丝易失水枯萎, 寿命缩短, 生活力丧失, 花粉在柱头萌发困难, 造成授粉效果差, 最终导致玉米产量降低。对于细胞的微观结构, 有研究指出, 叶肉细胞中核仁对高温最为敏感, 叶绿体比线粒体对高温更敏感, 液泡膜比质膜对高温更敏感; 在叶绿体中, 类囊体膜比叶绿体被膜对高温更敏感[4]。高温胁迫除了影响植物生长发育外, 还会影响一系列生理生化反应。高温会打破活性氧(reactive oxygen species, ROS)的产生与清除间的平衡, 诱导ROS、丙二醛(MDA)等氧化产物的积累, 引起膜脂过氧化, 从而使膜透性增大, 细胞内电解质外渗, 电导率升高[5, 6]。光合作用是植物物质转化和能量代谢的关键, 也是对高温最敏感的生理过程之一。热胁迫下, 类囊体上的光化学反应和叶绿体基质上的碳代谢最先受到危害[7]。尤其是夏季高温往往伴随着强光, 会进一步导致光系统Ⅱ (PSⅡ )结构和功能的变化甚至不可逆失活[8, 9]。Yamada等[10]发现叶绿素荧光、最大光化学效率(Fv/Fm)和基础荧光(Fo)等也与耐热性密切相关。呼吸作用作为代谢中心, 不仅为细胞各项生理活动提供能量, 又能为其他化合物的合成提供原料。一般情况下, 在一定温度范围内, 呼吸速率随着温度升高而加快[11]。但是, 当温度超过一定范围, 反而会引起呼吸代谢减弱[12]。
处于高温胁迫下的植物并不会一直被动承受伤害, 而是通过主动调节来适应高温逆境。植物通过激活抗氧化剂和诱导抗氧化酶的活性来减弱膜脂过氧化程度[13, 14]。不仅如此, 植物还能依赖脯氨酸、可溶性蛋白、甜菜碱等渗透调节物质和激素来提高自身的耐热性。大量研究表明, 脯氨酸和可溶性蛋白作为最常见的渗透调节物质, 在逆境下能大量积累, 具有稳定原生质胶体和组织内的代谢过程, 防止细胞质脱水, 保护质膜完整性的作用[15, 16, 17]。此外, 甜菜碱含量的高低与耐热性强弱也有较为密切的关系[18, 19]。水杨酸(SA)和脱落酸(ABA)都是响应高温锻炼的重要信号分子, 高温胁迫均能诱导植物内源SA和ABA的大量积累, 而外施SA、ABA同样可以提高植物的耐热性[20, 21, 22, 23]。热激转录因子(heat stress transcription factors, Hsfs)是存在于细胞内, 响应逆境信号的重要元件, 在热胁迫下通过激活相关基因的表达来提高植物的耐热性[24, 25]。热激蛋白(heat shock protein, HSP)作为分子伴侣, 在高温胁迫下, 可以阻止变性的蛋白聚集、协助变性的蛋白重新折叠或溶解聚集的变性蛋白[26]。
中国南方地区夏秋播玉米种子在萌发和幼苗生长期间易受到高温胁迫, 并且这种现象在玉米自交系特别是甜玉米自交系上表现得尤为明显, 往往导致田间出苗率和幼苗整齐度下降, 进而影响制种产量。本试验采用浙江大学选育的耐热型和热敏感型甜玉米自交系各2份, 在室内45 ℃条件下进行高温胁迫处理, 测定了苗期叶片的生理生化变化, 研究和分析不同抗性的甜玉米自交系的逆境生理机制, 从而为抗逆材料的鉴定和选育提供参考。
浙江大学选育的不同种质来源的耐热型和热敏感型甜玉米自交系各2份, 其中耐热型为16号(S40-4-2-1-2-3-2, 种质来源:温带× 热带)和51号(S76-9-2-2-2-1, 种质来源:热带); 热敏感型为56号(T5-5-1-1-1-3-1, 种质来源:温带× 亚热带)和71号(T60-1-9-2-1, 种质来源:温带)。4份材料的种子发芽率均在85%左右, 发芽势和发芽率无显著差异。
荧光定量PCR试验所用RNA提取试剂盒购自北京华越洋生物科技有限公司; 反转录试剂盒(PrimeScriptTM RT reagent Kit)购自北京TaKaRa公司; 荧光定量试剂盒(AceQ qPCR SYBR Green Master Mix)购自南京诺唯赞生物科技有限公司。
1.2.1 高温处理与取样
采用基质培养。种子播于培养盒内, 每盒30粒, 合并3盒为1个重复, 每个处理3次重复, 置于25 ℃培养箱中发芽。待玉米幼苗长到一叶一心期时, 取出处理组, 置于45 ℃培养箱中处理24 h, 再置于25 ℃、12 h光照培养箱中恢复生长12 h。于高温处理0、12、24 h, 及恢复生长6、12 h时取样进行生理生化指标测定; 于高温处理0、1、3、5、8、12、24 h, 及恢复12 h取样, 液氮速冻后保存于-80 ℃冰箱用于后续基因表达量的测定。取样时均取幼苗第一叶, 所有测量指标重复3次。
1.2.2 生理生化指标测定
叶绿素含量测定。叶绿素提取参照李得孝等[27]的方法, 每个重复取0.2 g叶片样品, 使用丙酮: 乙醇: 水(体积比4.5: 4.5: 1.0)提取液直接在黑暗中浸提24 h, 待叶片发白取浸提液并定容至20 mL, 测定663、645 nm下的吸光度。
抗氧化酶系统活性测定。取0.2 g叶片在pH 7.8的磷酸缓冲液(PBS)中冰浴研磨成匀浆, 4 ℃, 10 000 g离心15 min, 弃沉淀, 上清液即为待测酶液。
超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)光化还原法[28]。3 mL NBT反应液中加入100 μ L待测酶液, 光照20 min(25 ℃, 4 000 lx), 以3 mL NBT反应液加上100 μ L提取缓冲液为对照。于560 nm波长下比色测定。
过氧化物酶(POD)活性测定参照赵文赛[29]的方法并略加修改。取上清液与磷酸缓冲液、愈创木酚、过氧化氢(H2O2)混匀, 利用分光光度计在470 nm处测定1 min内吸光值的变化。以每min吸光值上升0.1为1个酶活性单位。
过氧化氢酶(CAT)活性测定采用过氧化氢比色法[30]。取上清液与磷酸缓冲液、H2O2混匀, 用动力学方法在240 nm下测定其活性。
抗坏血酸过氧化物酶(APX)活性测定采用抗坏血酸比色法[31]。取上清液与磷酸缓冲液、抗坏血酸、H2O2混匀, 用动力学方法在290 nm下测定其活性。
谷胱甘肽还原酶(GR)活性测定参照Knorzer等[32]的方法并略加修改。取上清液与GSSG、NADPH混匀, 于340 nm处测定3 min内吸光值的变化。以每min吸光值下降0.1为1个酶活性单位。
脯氨酸含量测定。采用茚三酮显色法[33]。称取0.2 g玉米叶片, 剪碎后用5 mL 3%的磺基水杨酸加塞沸水浴提取10 min(提取过程中要不断晃动)。冷却后过滤于干净的试管中。取2 mL提取液, 于具塞试管中加入2 mL冰醋酸和2 mL酸性茚三酮试剂, 摇匀后在沸水浴中显色30 min。冷却后加入4 mL甲苯, 摇晃30 s, 静置片刻取上层液至10 mL离心管中, 3 000 r· min-1离心5 min, 吸取上层脯氨酸红色甲苯溶液, 在分光光度计上520 nm波长下比色, 以甲苯为空白对照。
1.2.3 荧光定量PCR(qRT-PCR)检测
以经过高温胁迫处理和正常生长的玉米幼苗叶片为试验材料, 提取总RNA, 反转录获得cDNA, 并以此为模板, 以ZmActin为内参基因, 用LightCycler® 96荧光定量仪进行扩增。反应总体积20 μ L, 包含100 ng cDNA(1 μ L), 7.4 μ L ddH2O, 上、下游引物各0.8 μ L, 10 μ L SYBR® Green Master Mix。测定ZmP5CS和ZmProDH表达水平的反应程序为:95 ℃ 3 min; 95 ℃ 10 s, 56 ℃ 15 s, 72 ℃ 15 s, 共45个循环。测定ZmHSP70和ZmHSP90表达水平的反应程序为:95 ℃ 3 min; 95 ℃ 10 s, 53 ℃ 15 s, 72 ℃ 15 s, 共45个循环。
采用Primer 5.0设计特异性引物(表1), 引物由杭州擎科梓熙生物技术公司合成。数据分析采用LightCycler® 96 system软件和2-Δ Δ CT法。
| 表1 实时定量PCR引物 Table 1 Real-time quantitative PCR primers |
4份甜玉米自交系幼苗经高温处理后恢复生长情况如图1所示。未经高温处理之前, 各自交系玉米幼苗处于一叶一心期, 均长势良好, 51号自交系叶片略有发黄, 可能是叶绿素含量较低, 其他自交系叶片深绿。45 ℃高温处理24 h后, 16号、51号、56号自交系叶片略微发黄, 但不明显; 71号自交系部分幼苗已经倒伏、萎蔫, 未倒伏的幼苗叶片焦黄, 下垂。恢复生长1 d后, 16号、51号自交系叶片发黄略微加重, 但仍旧正常生长; 56号自交系幼苗开始干枯倒伏, 叶片萎蔫; 71号自交系部分幼苗整株枯死, 其他幼苗叶片干枯, 下垂严重。恢复生长2 d后, 16号与51号自交系叶片转绿, 生长良好; 而56号、71号自交系基本已全部枯死。由此可见, 16号与51号自交系耐热性强, 高温处理后叶片略微发黄, 恢复正常温度后即可正常生长; 56号与71号自交系耐热性差, 高温处理后再恢复无法正常生长, 并且在恢复生长期间全部枯死; 同时, 与56号相比, 71号自交系对高温胁迫更敏感, 71号自交系在高温处理结束后便已经明显地出现生长异常, 56号自交系在恢复生长1 d后才出现异常情况。
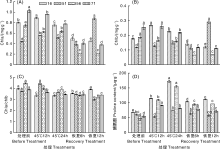
 | 图1 高温处理后甜玉米自交系幼苗的生长情况2.2 生理生化指标2.2.1 高温胁迫对不同抗性玉米幼苗叶绿素含量的影响Fig.1 Growth of sweet corn inbred line seedlings after high temperature treatment |
由图2-A可以看出, 71号和56号自交系的叶绿素a含量在高温处理和恢复生长期间始终呈下降趋势, 变化显著, 至恢复生长12 h后下降幅度分别达到63.4%和70.4%。51号和16号自交系高温处理12 h, 叶绿素a含量略微上升, 之后至恢复生长6 h期间, 叶绿素a含量均呈下降趋势; 但是在恢复生长12 h后, 51号自交系与16号自交系的变化相比存在极大的差异, 51号自交系叶绿素a含量急剧升高, 比恢复生长6 h时的叶绿素a含量增加了129.7%, 而16号自交系叶绿素a含量仍呈略微下降的趋势, 总降幅为44.1%。
叶绿素b含量的变化趋势与叶绿素a类似(图2-B)。71号自交系与56号自交系基本呈下降趋势, 总降幅分别达56.5%和62.6%。16号自交系高温处理12 h叶绿素b含量上升, 之后下降, 总降幅为31.8%。51号自交系在高温处理12、24 h时, 叶绿素b含量略微上升; 恢复生长6 h下降, 总降幅为5.93%; 但在恢复生长12 h后含量急剧上升, 与恢复生长6 h相比上升幅度达162.2%。
叶绿素a与叶绿素b的比值反映了植物对光能利用的能力。从图2-C可以看出, 71号与56号自交系的叶绿素a/b值呈下降趋势, 总降幅分别为12.4%和29.4%。16号自交系的叶绿素a/b值变化趋势与叶绿素含量的变化趋势相反, 在高温处理12 h下降, 高温处理24 h后开始上升, 但仍比未处理前略微下降。51号自交系的变化与16号自交系有所不同, 在高温处理12 h时, 叶绿素a/b值上升, 之后呈下降趋势, 这可能与51号自交系在处理前幼苗叶绿素含量较低、高温胁迫初始阶段反应相对敏感有关。
2.2.2 高温胁迫对不同抗性的玉米幼苗脯氨酸含量的影响
从图2-D可以看出, 高温胁迫处理后, 4个自交系的脯氨酸含量均有不同程度的上升。其中71号自交系在高温处理12 h后, 脯氨酸含量上升, 而高温处理24 h后, 脯氨酸含量下降, 恢复生长时期, 脯氨酸略微下降; 56号自交系在高温处理期间脯氨酸含量急剧上升, 至高温处理完成, 脯氨酸含量上升至最高点, 上升幅度达230.8%, 在恢复生长6 h, 脯氨酸含量迅速下降, 下降幅度为38.9%, 之后无显著变化; 51号自交系的脯氨酸含量在整个处理期间变化不大, 高温胁迫12 h略微下降, 高温胁迫24 h略有上升, 恢复生长期间缓慢下降; 16号自交系在高温处理期间脯氨酸含量急剧上升, 与处理前相比上升幅度为153.7%, 到恢复生长6 h迅速下降, 与高温处理24 h相比降幅为39.9%, 之后较为平稳。
2.2.3 高温胁迫对不同抗性玉米幼苗POD活性的影响
耐热性不同的4个自交系的POD活性在高温处理24 h后均呈下降趋势, 71号、56号、51号、16号下降幅度分别为59.8%、70.7%、55.8%和13.3%(图3-A)。在恢复生长期, 耐热性不同的自交系其POD活性变化有较大差异。71和56号自交系的POD活性基本趋于稳定, 无显著变化。51号和16号自交系的POD活性在恢复生长时期迅速回升, 与高温处理24 h相比, 至恢复生长12 h时POD活性分别上升了473.2%和54.2%。
SOD是生物体内唯一以自由基为底物的抗氧化酶, 因此在抗氧化酶体系中居于核心地位。抗性不同的自交系在高温胁迫下SOD活性变化有很大差异(图3-B)。71号自交系在高温处理12 h, SOD活性略微上升, 之后迅速下降, 至恢复生长6 h降至最低点, 比处理前下降了68.6%, 在恢复生长12 h略微回升。56号自交系一直呈下降趋势, 至恢复生长6 h降至最低点, 比处理前下降了71.7%, 在恢复生长12 h时也略微回升。51号自交系在高温处理12 h, SOD活性略有下降, 之后呈上升趋势, 恢复生长6 h至最高点, 之后迅速回落。16号自交系在整个处理期间SOD活性保持稳定, 且一直处于较高水平。
2.2.5 高温胁迫对不同抗性玉米幼苗CAT活性的影响
如图3-C所示, 4份甜玉米自交系的CAT活性在高温处理期间均呈下降趋势, 71号、56号、51号、16号下降幅度分别为94.6%、61.6%、70.8%和58.7%。恢复生长期间根据耐热性不同, 幼苗CAT活性也表现出明显差异。71号和56号自交系的CAT活性在恢复生长期间仍保持下降趋势; 而51号自交系自高温处理完成后CAT活性开始上升, 与高温处理24 h相比, 恢复生长12 h时上升幅度达4 260%; 16号自交系在恢复生长6 h达到最低点, 之后开始回升。
2.2.6 高温胁迫对不同抗性玉米幼苗APX活性的影响
71号和56号自交系的APX活性在高温处理及恢复生长期间一直呈下降趋势, 至恢复生长12 h, 降幅分别为90.4%和85.8%(图3-D)。51号自交系的APX活性在高温处理12 h下降到最低, 之后开始升高。16号自交系的APX活性在高温处理及恢复生长期间一直呈上升趋势, 与处理前相比, 至恢复生长12 h, 上升幅度为63.8%。
2.2.7 高温胁迫对不同抗性玉米幼苗GR活性的影响
在整个高温处理和恢复生长期间, 71号、56号和51号自交系均呈现先上升后下降的趋势, 而16号自交系呈现缓慢上升的趋势(图3-E)。热敏感型自交系71号和56号的GR活性在高温处理12 h达最高, 随后急剧下降, 与高温处理12 h相比, 恢复生长12 h时降幅分别为55.7%和72.4%。耐热型自交系51号的GR活性在高温处理24 h后达最高, 恢复生长期间逐步下降, 降幅仅为14.1%。
2.3.1 脯氨酸合成和降解相关基因
已有研究表明, Δ 1-吡咯啉-5-羧酸合成酶(Δ 1-pyrroline-5-carboxylate synthetase, P5CS)是谷氨酸途径合成脯氨酸的关键酶, 而脯氨酸脱氢酶(proline dehydrogenase, ProDH)是脯氨酸降解的主要限速酶[34, 35, 36]。如图4所示, 耐热性不同的玉米自交系脯氨酸合成和降解相关基因的表达存在明显差异。耐热性强的51号自交系在高温处理6 h后ZmP5CS的表达量迅速上升, 至12 h表达量达最高, 显著高于处理前的水平, 之后开始迅速回落, 恢复生长12 h后略高于处理前的水平; 而热敏感型自交系71号在高温处理12 h期间ZmP5CS的表达量呈现先缓慢上升后下降的趋势, 至24 h表达量达到峰值, 恢复生长12 h后表达量低于处理前的水平。ZmProDH的表达量在两个自交系中的表现大体一致, 51号和71号自交系在高温处理后骤然上升, 均在高温处理6 h后达到峰值, 显著高于处理前的表达水平, 上升幅度分别为192.0%和210.6%, 随后开始显著下降, 至高温处理24 h时, 71号的表达量与处理前相比无显著差异; 2个自交系在恢复生长12 h后的表达量均保持在较低水平, 并显著低于处理前水平。综合看来, 与热敏感型自交系相比, 耐热性强的自交系在高温胁迫期间, 脯氨酸合成酶基因的表达水平更高, 降解酶基因的表达水平较低。
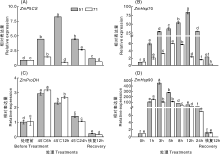 | 图4 高温胁迫下不同甜玉米自交系相关基因的表达2.3.2 热激蛋白相关基因Fig.4 Expression of related genes in different sweet corn inbred lines under high temperature stress |
研究发现, 热激蛋白在高温、干旱、过氧化、重金属等逆境下能大量表达[26]。如图4所示, 抗性不同的甜玉米自交系, 其热激蛋白表达水平在高温胁迫期间表现出明显差异。经高温处理后, 耐热型51号自交系ZmHSP70和ZmHSP90大量表达并分别于12 h和3 h达到峰值, 且显著高于处理前水平。而热敏感型71号自交系ZmHSP70的表达与处理前相比虽有显著升高, 但与51号自交系相比, 仍维持在较低水平; ZmHSP90在高温处理5 h内上升幅度较大, 在高温处理1 h时即达到峰值, 但高温处理3 h后的表达量均低于51号自交系。这与Scafaro等[37]在水稻上的研究结果一致。
本试验通过4份不同抗性的甜玉米自交系在高温胁迫和恢复生长期间的表现情况, 发现高温胁迫过程中脯氨酸的积累、抗氧化酶活性和热激蛋白基因表达的增强是玉米幼苗耐热性形成的响应机制。而本试验中叶绿素a、b含量, 叶绿素a/b值和脯氨酸含量变化存在的差异, 及脯氨酸合成与分解相关的基因表达与脯氨酸含量变化不一致等现象, 可能与高温胁迫对植物生长的影响机制比较复杂等有关。此外, 本试验主要目的在于分析甜玉米自交系在幼苗生长期间对高温胁迫的反应情况, 但苗期耐热性的形成是否与幼穗分化期、开花期耐热性具有一致表现尚有待更多的研究证明, 而这也可能为耐热型甜玉米自交系的选育提供新的思路。
目前, 关于玉米自交系苗期耐热性鉴定尚未形成较为一致的方法, 本试验在综合前人研究的基础上, 结合南方甜玉米夏播制繁种的实际情况和试验前期田间和室内预处理结果, 为了增强试验的胁迫压力, 采用45 ℃、24 h室内较高温度强化处理进行苗期耐热鉴定, 以便选取苗期耐热性更好的甜玉米自交系。通过本次试验可以发现, 耐热型自交系16号、51号幼苗在经过高温处理后仅表现出叶片略微发黄, 叶片的形态并未发生显著性变化, 恢复生长后, 叶片会恢复深绿; 而耐热性最差的71号自交系在高温处理期间叶片即发生萎蔫、干枯、下垂, 部分幼苗已经死亡, 至恢复生长后全部枯死; 从形态上看, 56号自交系的耐热性比71号略好, 高温处理结束后仅有个别幼苗形态发生改变, 但在恢复生长期间也全部枯死。
光合作用是植物最重要的生理反应之一, 极易受到高温影响。本次试验表明, 51号自交系的叶绿体耐热性强, 经高温胁迫后的恢复能力也较强。16号自交系在高温处理和恢复生长期间叶绿素含量整体呈下降趋势, 下降幅度显著小于56号和71号, 但恢复生长后叶绿素含量的继续下降可能与种子贮存的养分相对较少、后期供应不足有关。因此, 叶绿素含量的变化与植物的耐热性存在一定相关性, 这与前人的研究结果相一致[6]。总体来看, 高温胁迫会加速叶绿素的分解, 导致叶绿素含量的大幅下降。然而也有研究表明, 高温胁迫导致叶绿素含量下降的同时叶片也在不断蒸腾失水, 从而导致叶绿素相对含量增加[38]。
叶绿素a/b的值反映了植物对光能利用的程度, 比值越大说明对光能的利用能力越强, 这种现象在番茄和甘蔗的耐热性品种中均能观察到
植物体内游离脯氨酸含量在一定程度上可以表示植物对逆境的抵抗能力。本试验中, 71号自交系在高温处理期间脯氨酸含量仅略微上升, 之后缓慢下降, 说明其耐热性最差。热胁迫期间脯氨酸的大量积累可能是56号自交系的耐热性优于71号自交系的原因之一, 这与2个自交系在高温处理结束后存在较大差异相一致。16号自交系在高温胁迫期间脯氨酸含量的变化趋势与56号自交系类似, 说明脯氨酸是应对高温胁迫的渗透调节物质之一。但16号自交系在恢复生长期间脯氨酸含量下降的原因可能是多余的游离脯氨酸无需再维持渗透势, 转而参与植物的代谢过程; 而56号自交系在恢复生长期间逐渐枯死从而导致脯氨酸含量的下降。51号自交系脯氨酸含量一直维持在较低水平, 变化幅度小, 说明脯氨酸的渗透调节可能不是51号自交系应对高温胁迫的主要调节途径, 这也符合某些学者的论点, 即高温胁迫可以诱导游离脯氨酸的积累, 但其含量的高低与耐热性强弱没有表现出对应的关系[18, 42]。
此外, 本次试验还发现, 脯氨酸合成途径的关键基因ZmP5CS的表达受高温诱导, 在高温处理期间其表达量有所上升, 这与前人研究的P5CS基因受脱落酸、干旱和盐胁迫诱导, 不受高温或低温所诱导这一结论不相符[43]。同时, 耐热性不同的自交系ZmP5CS和ZmProDH在高温胁迫期间的表达趋势与自交系幼苗内脯氨酸含量的变化趋势并不一致, 可能是脯氨酸合成的谷氨酸途径中P5CS虽为限速酶, 但高温还会对该途径涉及的中间代谢物和其他酶类产生较大影响。最近研究结果也表明, P5CS和谷氨酸脱氢酶(glutamate dehydrogenase, GDH)才是逆境胁迫下植物体内脯氨酸合成的关键酶[34, 35, 36]。此外, 干旱和低温均能活化脯氨酸合成的2条途径, 且干旱胁迫下脯氨酸的积累更依赖于鸟氨酸途径[36, 44]。因此, 高温胁迫对鸟氨酸途径造成的影响或许也会导致这一现象发生。
抗氧化酶系统被认为是植物遭受环境胁迫时重要的防御体系。本试验发现, 耐热性弱的自交系经高温处理后SOD活性下降, 而耐热性强的自交系其SOD对高温胁迫的响应较强, 这也与前人的研究结果“ SOD活性的升高通常与植物对环境下胁迫的耐受性有关” 一致[45], 由此推测, SOD较高的稳定性和活性水平是其抵御高温胁迫的主要途径之一。同样, POD、CAT、APX和GR在高温下也能增强植物的耐热性, 并且在耐热型自交系中其热稳定性和恢复能力更强。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|