作者简介:杨敏(1993—),女,四川罗江人,硕士研究生,主要从事动物临床中兽医学研究。E-mail: yangmin1074335657@163.com
为了筛选有机溶剂DMSO与DMF对H9C2心肌细胞毒性作用的最低浓度,探讨DMSO与DMF对心肌细胞信号转导与转录因子3(signal transducer and activator of transcription 3,STAT3)信号通路的影响,通过四氮唑盐比色分析法(MTT法)试验,检测DMSO和DMF在体积分数为0.1%、0.2%、0.3%、0.5%、0.7%、0.9%、1%、2%、3%时作用24、48、72 h心肌细胞的存活率变化;Western blot法检测STAT3和Bcl-2蛋白,对比DMSO和DMF分别在0%、0.2%、0.3%、0.5%体积分数下STAT3蛋白表达量的差异性。结果表明,同一DMSO和DMF体积分数条件下,随着时间增加,细胞存活率下降,在同一时间随着DMSO和DMF体积分数的增加,心肌细胞存活率减小,Bcl-2和STAT3蛋白含量减少,DMSO体积分数为0.3%和0.5%时,细胞存活率有统计学意义( P<0.05),STAT3和Bcl-2蛋白水平比对照组低( P<0.01),但DMSO体积分数为0.2%,细胞存活率与STAT3、Bcl-2表达对比对照组,均无统计学意义( P>0.05);当DMF体积分数为0.3%和0.5%时,细胞存活率有统计学意义( P<0.05),STAT3和Bcl-2蛋白水平比对照组低( P<0.01),当DMF体积分数为0.2%时,细胞存活率无统计学意义( P>0.05),STAT3蛋白表达对比对照组,具有统计学意义( P<0.01)。与对照组(不含DMSO和DMF)比较,DMSO和DMF对H9C2心肌细胞具有毒性作用,随浓度增加,细胞存活率降低,Bcl-2蛋白含量降低,可能与STAT3蛋白下调相关,MTT法检测结果与Western blot试验结果不完全一致,MTT法具有不稳定性。
In order to screen the lowest concentration of toxic effects of organic solvents DMSO and DMF on H9C2 cardiomyocytes, and to investigate the effects of DMSO and DMF on signal transduction and transcription factor 3 (signal transducer and activator of transcription 3, STAT3) signal pathway, the survival rates of cardiomyocytes exposed to DMSO and DMF at volume fraction of 0.1%, 0.2%, 0.3%, 0.5%, 0.7%, 0.9%, 1%, 2%, 3% for 24 h, 48 h and 72 h, respectively, were detected by the tetrazolium salt colorimetric assay (MTT method). And the survival rate of STAT3 and Bcl-2 protein was determined by Western blot method, and the expression of STAT3 protein was compared between DMSO and DMF at 0%, 0.2%, 0.3%, 0.5% volume fraction, respectively. At the same time, the survival rate of cardiomyocytes decreased with the increase of the volume percentage of DMSO and DMF, and the content of Bcl-2 and STAT3 protein decreased. When the volume fraction of DMSO was 0.3% and 0.5%, the cell survival rate was significantly lower than that of the control group ( P<0.05). The protein levels of STAT3 and Bcl-2 were lower than those of the control group ( P<0.05). The survival rate of cardiomyocytes decreased with the increase of the volume percentage of DMSO and DMF, and the content of Bcl-2 and STAT3 protein decreased at the same time. However, when the volume fraction of DMSO was 0.2%, there was no significant difference in the cell survival rate and the expression of STAT3 and Bcl-2 compared with the control group ( P>0.05). When the volume fraction of DMF was 0.3% and 0.5%, the cell survival rate was statistically significant ( P<0.05), and the protein levels of STAT3 and Bcl-2 were lower than those in the control group. When the volume fraction of DMF was 0.2%, the cell survival rate was not statistically significant ( P>0.05). The expression of STAT3 protein was significantly higher than that in the control group ( P<0.01). Compared with the control group (without DMSO and DMF), DMSO and DMF had toxic effects on H9C2 cardiomyocytes. With the increase of concentration, the cell survival rate decreased and the content of Bcl-2 protein decreased, which may be related to the down-regulation of STAT3 protein. The results of MTT assay were not completely consistent with those of Western blot test, and MTT assay was unstable.
H9C2心肌细胞用于筛选临床药物时, 常面临药物溶解度低的问题, 因此筛选助溶剂是溶解药物的关键一步。助溶剂必须满足低毒、助溶效果优良、不改变药物本身的特性。二甲基亚砜(DMSO)和N, N-二甲基甲酰胺(DMF)为较常用的有机助溶剂。DMSO是一种广泛使用的可溶于水的非质子溶剂, 增溶能力强, 低毒, 具有透过生物膜的能力, 可诱导细胞发生凋亡[1, 2]。DMF则作为最有效的极性溶剂之一, 有很好的溶解性, 高沸点, 低毒性, 价格低廉, 在有机合成、高分子制备、制药等领域广泛应用[3]。DMSO与DMF都具有低毒性, 但对H9C2心肌细胞的毒性作用有待进一步研究。近年来发现信号转导与转录激活因子3(STAT3)信号通路与心脏炎症、血管再生、肿瘤、新陈代谢密切相关, 调节细胞增殖、分化、凋亡过程, 在炎症反应中发挥作用, 影响bcl-2、cyclinD1、matrix metalloproteinase-2基因转录活性[4, 5]。当抑制STAT3活性时, 可导致细胞凋亡, 激活STAT3, 进而抑制细胞凋亡[6]。DMSO与DMF对心肌细胞的毒性作用, 可能与STAT3信号通路的调控相关。通过MTT法和Western blot试验, 检测DMSO和DMF不同体积分数对H9C2心肌细胞的毒性作用与STAT3蛋白表达影响, 以期为H9C2心肌细胞试验药物助溶剂的选择提供参考, 为研究H9C2心肌细胞的STAT3蛋白通路相关领域提供参考。
DMEM培养基、胎牛血清、双抗、0.25%的胰蛋白酶、无菌PBS, 均购自美国Gibco公司; DMSO和DMF, 购自美国SIGMA公司; MTT、彩虹180光谱蛋白Marker、5% BSA封闭液, 均购自Solarbio公司; M-PER细胞裂解液, 购自美国Thermo Fisher Scientific公司; Beta Actin Mouse McAb抗体, 购自美国Proteintech公司; STAT3兔单克隆抗体, 购自美国Cell Signaling Technology公司; Bcl-2兔多克隆抗体, 购自美国Abcam公司; 山羊抗鼠和山羊抗兔多克隆抗体, 购自中杉金桥公司。
CO2恒温培养箱, 购自Heal Force广州安邦生物公司; 全自动细胞计数仪, 购自美国 Nexcelom 公司; 离心机, 购自美国SIGMA公司; 全波长酶标仪, 购自美国Thermo Fisher Scientific公司; 倒置显微镜, 购自德国徕卡LEICA公司。
鼠源H9C2心肌细胞, 购于中国科学院上海细胞库。
制备含10%胎牛血清和1%双抗的DMEM细胞完全培养液, 于-80 ℃取出H9C2细胞冻存管, 立即放入37 ℃水浴, 当心肌细胞完全融化后, 加入DMEM细胞完全培养液, 4 ℃, 1 000 r· min-1, 离心5 min后, 弃去细胞液, 加入DMEM细胞完全培养液, 轻轻吹打底部细胞悬浮后, 接种至75 mm2细胞瓶, 37.5 ℃, 5% CO2恒温培养2~3 d。倒置显微镜观察细胞生长情况, 当平铺细胞量为90%以上, 进行细胞传代, 完全弃掉细胞液, 磷酸盐缓冲液(PBS)洗涤一次, 加入5 mL 0.25%的胰蛋白酶, 37.5 ℃消化2 min, 轻拍细胞瓶, 促使细胞消化完全, 加入10 mL含胎牛血清的细胞培养液终止消化, 接种于新的细胞培养瓶培养。
分别取10、20、30、50、70、90、100、200、300 μ L的DMSO和DMF分别加入10 mL的DMEM高糖完全细胞培养液中, 配比为0.1%、0.2%、0.3%、0.5%、0.7%、0.9%、1.0%、2.0%、3.0%体积分数的DMSO与DMF细胞培养液, 经0.22 μ m· L-1的微孔滤膜过滤除菌后分别加入75 mm2细胞培养瓶培养。
将处于对数增长期的H9C2细胞制备为细胞悬液, 以1× 105 mL-1的细胞密度接种于96孔板中, 每孔100 μ L, 培养24 h后, 加入不同体积分数的DMSO和DMF, 每孔重复5个平行试验, 共设置7列试验组(加入含不同体积分数的DMSO和DMF), 2列对照组(细胞加培养液), 1列空白组(无细胞, 只加细胞培养液), 围绕试验组、对照组、空白组外圈每孔加入100 μ L无菌PBS, 置于5% CO2的37.5 ℃恒温培养箱培养。避光使用无菌PBS配制5 mg· mL-1的MTT溶液, 经0.22 μ m· L-1的微孔滤膜过滤除菌, 试验组、对照组和空白组每孔加入20 μ L, 在含5% CO2的37.5 ℃恒温培养箱培养4 h后, 彻底吸弃除无菌PBS孔的液体后, 每孔加入150 μ L DMSO, 轻轻吹打几下, 低速振荡10 min, 置于酶联免疫检测仪中, 设置吸收波长为450 nm, 测定D值。6个96孔板重复相同操作, 分别于24、48、72 h各取出一个96孔板, 每个浓度实验结果重复5次, 取平均值计算细胞存活率。细胞存活率(%)=(实验组D均值-空白组D均值)/(对照组D均值-空白组D均值)× 100。
将H9C2细胞接种在75 mm2细胞瓶中, 加入15 mL含有10% FBS和1%双抗的DMEM, 置于含5% CO2的37.5 ℃恒温培养箱中。根据细胞毒性试验(MTT法)结果, 选取DMSO和DMF体积分数为0、0.2%、0.3%和0.5%加入75 mm2细胞培养瓶中, 培养72 h后, 取出细胞瓶放于冰盒上, 每75 mm2中加入1 mL细胞裂解液, 置于含5% CO2的37.5 ℃恒温培养箱中孵育3 min, 加入含10% FBS终止消化, 在方形冰盒上使用细胞刮充分刮下贴壁的细胞, 吸取细胞裂解液加入无菌1.5 mL EP管中, 放于冰盒上。收集蛋白完毕后, 平衡EP管后放于离心机, 12 000 r· min-1离心10 min, 取上清加入无菌1.5 mL EP管中, 按照5-1样品体积加5× 蛋白上样缓冲液, 沸水浴7 min, 取出样品放于-80 ℃保存。检测目的蛋白STAT3和Bcl-2, 先进行SDS-PAGE凝胶电泳, 再半干转膜, TBS洗涤3次, 10 min一次, 5% BSA封闭1 h, 4 ℃分别孵育STAT3抗体和Bcl-2抗体(5% BSA分别稀释抗体, 比例均为1:1 000)过夜, TBST充分洗涤3次, 每次10 min, 加入含辣根过氧化物酶(HRP)标记的二抗(稀释比1:2 500)室温振荡1 h, TBST或TBS洗3次, 每次10 min, 将含目的蛋白的NC膜放入显影仪, 滴加显影液(按照体积比1:1配比)显影, 拍照记录, 以β -actin作为内参, 使用Image J图像分析软件分析。
采用SPSS 19.0进行统计学分析, 以P< 0.05和P< 0.01分别作为差异显著性和差异极显著性判定标准。
观察加入0.3% DMSO和DMF培养心肌细胞24 h后形态变化, 细胞生长较为缓慢, 部分出现凋亡, 形态短缩、不规则, 细胞悬浮等变化。随着时间的延长, 在48 h和72 h细胞贴壁数量减少, 空泡、悬浮细胞量增加。
H9C2心肌细胞在DMSO和DMF不同体积分数作用下, 通过MTT分别检测24、48和72 h细胞存活率变化(表1和表2), 在DMSO和DMF体积分数为0.3%时, 72 h对比48 h细胞存活率具有统计学意义(P< 0.05), 并随着DMSO体积分数的增加, 细胞存活率逐渐下降。
| 表1 MTT法检测DMSO对心肌细胞存活率的影响 Table 1 Effect of DMSO on myocardial cell survival rate by MTT assay |
| 表2 MTT法检测DMF对心肌细胞存活率的影响 Table 2 Effect of DMF on myocardial cell survival rate by MTT assay |
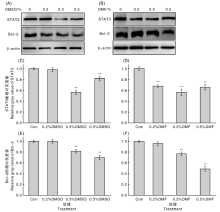
检测DMSO和DMF作用H9C2心肌细胞72 h后, STAT3和Bcl-2的蛋白表达变化。如图3所示, 与对照组比较, DMSO和DMF体积分数为0.3%和0.5%时, STAT3和Bcl-2蛋白的相对灰度值都具有统计学意义(P< 0.01), 但DMF体积分数为0.2%, STAT3有统计学意义(P< 0.01), Bcl-2无统计学意义; DMSO体积分数为0.2%时, STAT3和Bcl-2与对照组比较均无统计学意义(P> 0.05)。
DMSO和DMF常被用作生物研究中的溶剂和药物治疗的载体, 可与多种有机和无机物质完全混合, 应用于治疗疾病和科学试验研究中, 对不同细胞的毒性作用不可被忽略。有研究报道, DMSO对血液系统、兔视网膜上皮细胞等具有毒性作用, 高浓度影响外周血单个核细胞(PBMCs)增殖和细胞因子分泌, 在低浓度下降低T淋巴细胞的活性, 抑制细胞的生长和细胞因子的分泌[7, 8, 9, 10, 11], 但体外试验DMSO为0.1%~0.8%时作用大鼠心肌细胞6 h, 对细胞活力无影响, 抗氧化损伤作用机制与OH-1表达上调有关[12], 推测DMSO对心肌细胞损伤具有治疗作用, 体内试验却验证DMSO对脑死亡的大鼠心肌细胞无治疗作用, 脑死亡(BD)所致大鼠心肌细胞凋亡作用机制与JNK信号通路的激活通过线粒体通路介导相关, 线粒体凋亡通路受Bcl-2、caspase-3、Bax、Cyt-c蛋白影响[13]。DMF对消化系统、泌尿系统、心血管系统、生殖系统等具有损伤作用, 主要通过皮肤和呼吸道感染。体外试验DMSO对心肌细胞产生炎性损伤作用, 受活性氧和NF-κ B调控[14]。本研究发现, DMSO和DMF对H9C2心肌细胞具有不同程度的毒性作用, 抑制细胞生长, 随着体积分数增加, 细胞存活率逐渐降低, Bcl-2和STAT3蛋白表达均有下调, 但当DMSO和DMF体积分数增加至0.5%时, STAT3表达上调, 推测与机体平衡自身稳态相关, 提示Bcl-2与STAT3蛋白可能共同调控DMSO和DMF对心肌细胞的凋亡机制。
Bcl-2家族分为抗凋亡和促凋亡蛋白。抗凋亡蛋白Bcl-2在线粒体介导的凋亡中起着重要的调节作用, 通过表达上调, 抵抗细胞凋亡损伤, 癌细胞常常依赖Bcl-2来保护自己不受凋亡的影响。众所周知, Bcl-2蛋白的分布是一个决定细胞命运的动态过程。Bcl-2存在于线粒体、平滑的内质网(ER)、高尔基体、过氧化物酶体和细胞核中。Bcl-2主要定位于线粒体外膜, 可抑制程序性细胞死亡, 通过控制线粒体外膜通透性(MOMP), 在线粒体中保留细胞色素C, 抵抗细胞凋亡损伤[15]。Bcl-2蛋白的过度表达可以抑制Bax和Bak的激活, 阻止细胞色素C的释放和caspase的激活共同改变细胞凋亡[16]。Bcl-2可抑制程序性细胞死亡, 细胞淋巴瘤-2(bcl-2)家族的蛋白决定细胞的生命和线粒体自杀程序的凋亡, 在程序性细胞死亡中, 线粒体凋亡可能是最常见的形式, 主要是去除多余的、感染的或受损的细胞[17]。线粒体是心肌细胞主要的能量供应, DMSO和DMF作用心肌细胞产生凋亡, 检测抗凋亡蛋白Bcl-2表达降低, 心肌细胞线粒体发生凋亡, 细胞出现程序性死亡。
信号转导和转录激活因子3(STAT3)在多种细胞和组织中表达, 是调节细胞增殖、凋亡和自噬等重要细胞过程的转录因子[18]。STAT3在几种实体癌和血液病中的一个或两个残基中被组成性磷酸化, 活化的STAT3从细胞质转移到细胞核, 与特定的启动子序列结合, 然后调节抗凋亡和细胞周期, 调控基因产物(如Bcl-2、XIAP和cyclinD1)的转录激活, 发挥抗凋亡作用[19, 20]。DMSO和DMF可能通过降低心肌细胞STAT3发生磷酸化, 抑制Bcl-2蛋白表达, 使细胞存活率下降。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|