作者简介:沈升法(1969—),男,浙江富阳人,学士,副研究员,从事薯类育种与栽培研究。E-mail: 3398809937@qq.com
HPLC-ELSD法测定植物可溶性糖具有灵敏度高、检出限低、线性范围大等优点。为了了解甘薯品种的可溶性糖组分和糖化特点,对11份甘薯重要种质资源的生薯和熟薯可溶性糖含量进行了测定和差异分析。结果表明,甘薯的生薯和熟薯均含有果糖、葡萄糖、蔗糖和麦芽糖,试验群体的平均含量分别为58.41 mg·g-1和123.05 mg·g-1。在生薯可溶性糖中,蔗糖含量最高,占可溶性糖的45%左右,麦芽糖含量最低,仅占可溶性糖的10%左右。在熟薯可溶性糖中,麦芽糖含量最高,其中约90%来源于蒸熟过程中淀粉的转化,增量可占熟薯可溶性糖的50%以上。熟薯中的果糖、葡萄糖、蔗糖主要来源于生薯可溶性糖,在甘薯蒸熟过程中变化较小。因此,甘薯的熟薯可溶性糖含量高低是由麦芽糖含量决定的。浙薯13蒸熟糖化效果好,熟薯可溶性糖和麦芽糖含量分别为179.64 mg·g-1和138.44 mg·g-1,均显著高于其余10个品种。红皮白心是一个生薯高糖品种,生薯可溶性糖和果糖含量均居参试品种之首。
The determination method of plant soluble sugar by HPLC-ELSD has the advantages of high sensitivity, low detection limit and large linear range. In order to understand the soluble sugar components and saccharification characteristics of sweetpotato varieties, the soluble sugar content of 11 important sweetpotato germplasm resources had been measured and analyzed. The results showed that fructose, glucose, sucrose and maltose were all contained in the soluble sugars of both raw root and cooked root,and the average content of the tested group were 58.41 mg·g-1 and 123.05 mg·g-1, respectively. Among the soluble sugars in raw root, sucrose content was the highest, accounting for about 45% of the soluble sugars, while maltose was the least, only accounting for about 10% of the soluble sugars. Among the soluble sugars in cooked root, maltose was the highest, about 90% of which came from the conversion of starch during steaming, and the increment accounted for more than 50% of the soluble sugars in cooked root. Fructose, glucose and sucrose in cooked root mainly came from soluble sugars in raw root, while their changes were small during steaming. Therefore, soluble sugar content in cooked root of sweetpotato was determined by maltose content. Zheshu 13 had a good effect of saccharification after steaming, in which the content of soluble sugar and maltose were 179.64 mg·g-1 and 138.44 mg·g-1, respectively, significantly higher than the other 10 varieties. Hongpibaixin was a variety with high sugar in raw root, and the content of soluble sugar and fructose in raw root ranked first among the varieties tested.
甘薯可溶性糖含量是甘薯食用品质和加工性能的重要指标之一。已有研究表明, 甘薯食味与生薯可溶性糖含量无关, 而与熟薯可溶性糖含量有关[1, 2], 熟薯可溶性糖不仅影响甘薯的甜度, 而且也会影响甘薯的黏度、质地和香味[3]。在植物可溶性糖的测定中, 一般采用蒽酮比色法和二硝基水杨酸法测定还原糖和可溶性糖含量, 但这2种方法不能测定可溶性糖组分, 较早的可溶性糖组分检测一般采用高效液相色谱-示差折光检测器法(HPLC-RID), 该方法依据折射率的变化进行检测, 极易受温度、流动相梯度等影响而导致色谱基线漂移, 灵敏度偏低, 实际应用并不理想 [4, 5]。近年来, 用高效液相色谱-蒸发光散射检测器(HPLC-ELSD)测定可溶性糖的方法得到了广泛应用。蒸发光散射检测器基于样品颗粒对光的散射与质量呈指数关系进行测定, 对没有紫外吸收、荧光或电活性的物质均能产生良好响应, 用于可溶性糖组分检测有灵敏度高、检出限低、线性范围大、各水溶性糖分离效果好的优点[6, 7]。目前国内仍未有HPLC-ELSD法测定甘薯可溶性糖的相关报道。
从2017年开始浙江省举行了第三次全国农作物种质资源普查与征集, 目前已经征集甘薯种质114份, 本试验采用其中11份重要种质进行了甘薯生薯和熟薯可溶性糖含量HPLC-ELSD法测定, 以期了解这些种质的可溶性糖组分和糖化特点, 并初步探索大批量样品的甘薯可溶性糖含量连续快速测定方法。
参试品种来自2019年浙江省农业科学院在杭州的甘薯种质资源鉴定圃, 11份种质均来源于2017— 2018年浙江省第三次全国农作物种质资源普查与征集(表1), 其中4 份(采集编号“ P” 字头)来源于各县市区普查征集, 7份来源于浙江省农业科学院种质资源调查队系统调查收集。来源地有浙江省8个地区市11个县市区, 其中红皮白心、金瓜黄、南瓜番薯、蜜东为地方品种, 胜利百号、瑞薯1号、徐薯18、苏薯4号、苏薯8号为2000年以前育成的老品种; 浙薯13、心香由浙江省农业科学院分别于2005年、2007年育成, 目前是浙江省主导品种。收获的新鲜甘薯储藏45 d后, 每份种质选取3个中等大小、约150 g典型薯块用作检测样品。
| 表1 十一份甘薯种质资源的基本信息 Table 1 Basic information of 11 sweetpotato germplasm resources |
1.2.1 样品处理
新鲜薯块纵切两半, 一半用于生薯可溶性糖测定, 另一半蒸熟后用于熟薯可溶性糖测定。生薯从纵切面均匀刮取1.000 g, 在研钵中加1 mL水研磨匀浆, 用4 mL水分2次冲洗入离心管中室温放置2 h, 在XH-D Vortex Mixer上涡旋振荡均匀后Centrifuge 5810 R离心机4 000× g离心10 min, 吸取上清液1mL, 加3 mL乙腈, 用0.22 μ m微孔滤膜过滤后待色谱分析。熟薯从纵切面均匀刮取1.000 g, 直接在加5 mL水的离心管中4 ℃浸泡过夜, 间隔30 min涡旋振荡3次后4 000× g离心10 min, 取上清液0.1 mL, 加0.57 mL水和2 mL乙腈, 用0.22 μ m微孔滤膜过滤后进行色谱分析。
1.2.2 色谱分析
检测设备为Agilent 1260 InfintiyⅡ 高效液相色谱仪、AllChrom ELSD 6000蒸发光散射检测器。固定相采用PrevailTM Carb ES Coumn-W 250 mm× 4.6 mm柱, 流动相为乙腈-水(体积比65∶ 35), 流速0.8 mL· min-1, 柱温30 ℃, 漂移管温度95 ℃, 氮气流量2.4 mL· min-1, 进样量4.0 μ L。
测定可溶性糖的生薯取样1 g后剩余部分用于干物率测定。生薯刨丝后用80 ℃烘干至质量恒定。
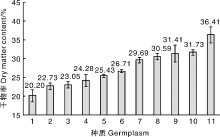
11份种质的干物率范围为20.20%~36.41%, 其中金瓜黄、苏薯4号、苏薯8号、红皮白心为低干品种, 瑞薯1号、南瓜番薯、蜜东为中干品种, 胜利百号、徐薯18、心香、浙薯13为高干品种(图1)。参试品种有较好的干物率代表性。
由图2可以看出, 在固定相柱温30 ℃, 流动相流速0.8 mL· min-1, 漂移管温度95 ℃, 氮气流量2.4 mL· min-1不变的情况下, 样品溶液和流动相中乙腈∶ 水(V∶ V)分别为75∶ 25和65∶ 35时, 果糖、葡萄糖、蔗糖和麦芽糖4种组分能完全分离, 且检测时间短, 4种组分的峰值保留时间(RT)依次为5.76、6.67、7.57、8.47 min, 即每份样品的检测时间可以缩短至10 min, 适合对大批量甘薯种质资源的连续快速测定(图2)。4种组分标准样浓度与测定结果均呈良好的对数线性相关(表2), 样品溶液的测定范围果糖、葡萄糖、蔗糖均为20~800 μ g· mL-1, 麦芽糖为40~1 600 μ g· mL-1。
 | 图2 果糖、葡萄糖、蔗糖和麦芽糖的色谱图 1, 果糖; 2, 葡萄糖; 3, 蔗糖; 4, 麦芽糖。下同。Fig.2 Chromatograms of fructose, glucose, sucrose and maltose 1, Fructose; 2, Glucose; 3, Sucrose; 4, Maltose. The same as below. |
| 表2 果糖、葡萄糖、蔗糖和麦芽糖标准曲线的回归方程 Table 2 Regression equation of standard curves for fructose, glucose, sucrose and maltose |
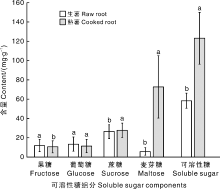
测定结果表明, 在11份甘薯种质资源的生薯和熟薯中均检测出果糖、葡萄糖、蔗糖、麦芽糖4种可溶性糖。由于甘薯熟化时淀粉在淀粉酶作用下转化为大量麦芽糖, 为了确保样品各种糖分浓度分布于色谱测试线性范围, 因而生薯和熟薯的溶液稀释倍数不同, 两者分别为24倍液和160倍液。如图3所示, 虽然生薯和熟薯溶液色谱分离的果糖、葡萄糖、蔗糖峰值和峰面积差异很大, 但换算后这3种组分含量测定值在生薯和熟薯间的差异较小。麦芽糖的峰值和峰面积在生薯和熟薯间差异很大, 生薯和熟薯峰面积分别为433.96和2 690.57, 麦芽糖含量测定值分别为7.28和75.13 mg· g-1, 说明在甘薯蒸熟过程中其可溶性糖变化主要在于淀粉水解产生了大量麦芽糖。
11份甘薯种质的生薯和熟薯可溶性糖含量之间多重比较结果(图4)表明, 甘薯在蒸熟过程中可溶性糖含量发生了显著的变化。在生薯中蔗糖含量最高, 平均含量为26.48 mg· g-1, 占可溶性糖的45.33%, 其次为葡萄糖、果糖, 平均含量分别为12.11和13.68 mg· g-1, 麦芽糖最少, 仅占可溶性糖的10.41%。蒸熟后可溶性糖从原来生薯平均含量58.41 mg· g-1基础上增加了64.63 mg· g-1, 增量占熟薯可溶性糖的50.60%。其中, 麦芽糖含量变化最大, 从生薯平均含量6.08 mg· g-1提高至72.63 mg· g-1, 即91.93%的麦芽糖来自蒸熟过程中淀粉转化, 增量66.55 mg· g-1, 占熟薯可溶性糖的52.14%。说明甘薯熟化过程中产生了大量的麦芽糖, 其增量比可溶性糖增量还要多。除葡萄糖含量变化不显著外, 果糖和蔗糖含量也发生了显著变化, 但变化幅度并不大, 果糖和葡萄糖含量分别下降了1.40和2.03 mg· g-1, 蔗糖含量增加了1.58 mg· g-1, 三者含量合计下降了1.85 mg· g-1, 其变量仅占熟薯可溶性糖含量的1.50%, 说明熟薯中果糖、葡萄糖和蔗糖含量主要来自生薯可溶性糖, 在蒸熟过程中变化较小; 熟薯可溶性糖含量高低是由麦芽糖含量决定的。
由表3可知, 浙薯13的熟薯可溶性糖和麦芽糖含量分别为179.64和138.44 mg· g-1, 均居参试品种第1位, 显著高于其余10个品种, 麦芽糖增量为123.50 mg· g-1, 占熟薯可溶性糖的68.75%, 同时干物率高达36.41%, 与其他品种相比, 贮藏45 d后生薯可溶性糖含量并不高; 因此, 浙薯13是一个淀粉、鲜食和薯脯加工兼用的优良品种。蜜东的熟薯可溶性糖和麦芽糖含量分别为155.58和115.45 mg· g -1, 均居参试品种第2位, 麦芽糖增量为103.91 mg· g-1, 占熟薯可溶性糖的66.79%; 紫红皮橘黄肉, 干物率29.69%, 是一个优异的食用品种。心香的熟薯可溶性糖和麦芽糖含量分别为141.12和97.57 mg· g-1, 均居参试品种第3位, 同时生薯果糖含量为11.15 mg· g-1, 显著高于浙薯13、徐薯18、胜利百号其余3个高干品种, 蒸熟后在所有品种中其果糖含量降幅最大, 下降了4.44 mg· g-1, 降幅显著大于除南瓜番薯、苏薯8号、金瓜黄外的其余7个品种。红皮白心曾经在浙江省20世纪60— 70年代被用作水果番薯, 其生薯可溶性糖和果糖含量分别为72.89和19.63 mg· g-1, 均居参试品种第1位, 是一个生薯高糖品种。胜利百号是20世纪40年代从日本引进的优良品种, 其熟薯中的蔗糖含量为40.48 mg· g-1, 居参试品种第1位, 但熟薯可溶性糖含量居末位。
| 表3 十一份甘薯种质资源的生薯和熟薯可溶性糖含量 Table 3 Soluble sugar content in raw and cooked storage roots of 11 sweetpotato germplasm resources mg· g-1 |
甘薯的生薯和熟薯中均含有果糖、葡萄糖、蔗糖和麦芽糖4种可溶性糖。在生薯可溶性糖中, 蔗糖含量最高, 占可溶性糖的45%左右, 其次是葡萄糖、果糖, 麦芽糖最少。甘薯蒸熟过程中淀粉转化成大量麦芽糖, 在11份种质资源的平均水平上, 麦芽糖增量约占熟薯麦芽糖的90%, 占熟薯可溶性糖的52.14%。熟薯中的果糖、葡萄糖、蔗糖主要来源于生薯可溶性糖, 在甘薯蒸熟过程中变化较小。因此, 甘薯的熟薯可溶性糖含量高低是由麦芽糖含量决定的。
甘薯品种间因淀粉酶活性不同导致糖化难易程度相差较大, 鲜食和薯脯、薯酱加工的甘薯应选择易糖化的品种[8]。在贮藏期间, 由于不同品种淀粉酶活性变化差异, 甘薯可溶性糖含量呈不同的波动变化, 但多数品种的淀粉酶活性高峰值出现在贮藏 30~60 d, 此时可溶性糖含量明显提升[9, 10]。本试验为更好地考察甘薯品种间可溶性糖含量差异, 选择贮藏45 d后的薯块进行可溶性糖检测。浙薯13作为高淀粉品种有优异的淀粉、鲜食和薯脯加工兼用性, 深受浙江省内和山东、河南等市场欢迎, 在同等原料及其产品上有较好的品质和价格优势。在本试验中, 浙薯13的蒸熟糖化效果最好, 熟薯可溶性糖和麦芽糖含量分别高达179.64和138.44 mg· g-1, 均显著高于其余10个品种, 蒸熟时产生的麦芽糖增量占熟薯可溶性糖的68.75%。若根据王文质等[11]的甘薯干物率估算淀粉含量公式y=0.86945x-6.34587, 以及淀粉转化成麦芽糖方程式2(C6H10O5)n+2nH2O=nC12H22O11推算, 浙薯13熟薯中至少有52%的淀粉已经转化成麦芽糖。心香是国内迷你甘薯的标志性品种, 适合鲜食与烤薯[12], 在本试验中, 一方面, 其熟薯可溶性含量为141.12 mg· g-1, 居参试品种第3位, 至少44%的淀粉转化成麦芽糖, 有良好的蒸熟糖化效果。另一方面, 与其他高干品种相比, 其生薯的果糖较高, 且在所有品种中蒸熟后果糖降幅最大, 这也许与心香在熟化过程中浓郁的薯香味形成有关, 因为已有研究认为, 甘薯香味主要来源于高温熟制过程还原糖参与的美拉德反应和焦糖化反应[13], 其中果糖形成的风味最佳[14]。地方品种蜜东也有优异的蒸熟糖化效果, 蒸熟时产生的麦芽糖增量占熟薯可溶性糖含量的66.79%, 至少有56%的淀粉已经转化成麦芽糖。地方品种红皮白心是一个生薯高糖品种, 其生薯可溶性糖含量高达72.89 mg· g-1, 居参试品种第1位, 同时果糖含量也最高。果糖是所有糖分中最甜的, 若蔗糖的甜度为1, 则果糖、葡萄糖、麦芽糖的甜度分别为1.75、0.70、0.35[15]。
样品制备对甘薯可溶性糖含量的色谱测定十分重要, 张娟等[16]认为对蒸熟甘薯可溶性糖提取影响最大的是料液比, 适当加大水量有利于提高提取率。卞科等[17]用80%乙醇提取甘薯可溶性糖, 色谱测定结果表明, 在7个品种中生薯干基可溶性糖含量最高仅约3.7 mg· g-1, 并且均没有检测出麦芽糖, 可能与样品可溶性糖提取时加水量不足有关。本试验样品可溶性糖采用在室温或4 ℃下用水浸泡方式提取, 避免加温对淀粉酶的淀粉水解作用造成影响。色谱测定的试验群体平均生薯和熟薯可溶性糖含量分别达到了58.41、123.05 mg· g-1, 与吴列洪等[2]报道的试验群体结果基本一致, 说明该样品制备方式是可取的。另外, 提取上清液与乙腈(体积比25∶ 75)混合后再用0.22 μ m微孔滤膜过滤, 可以滤去一些阻塞固相柱的可溶性蛋白和多糖等大分子物质[18, 19], 有利于大批量样品甘薯的可溶性糖连续快速色谱测定。
(责任编辑 张 韵)
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|