作者简介:徐莉(1984—),女,安徽宁国人,硕士,实验师,主要从事微生物防治方面的研究。E-mail: 61267156@qq.com
课题组前期从健康杜仲叶片中分离得到1株内生细菌枯草芽孢杆菌DZSG23,此菌可以较好地防控小麦赤霉病。为明确芽孢杆菌DZSG23在小麦中的定殖与强化抗病机制研究,利用抗生素标记法分析了DZSG23菌体在小麦组织中的定殖情况,采用荧光定量PCR技术检测不同生育期小麦穗部 PR-1、 AOS、 ACOI等基因的表达水平变化。结果表明,DZSG23可在苗期小麦植株和小麦穗表面稳定定殖;DZSG23浇灌接种苗期小麦后的第34天,DZSG23在苗期小麦植株的根、茎和叶中的定殖量分别达到1.437×106 CFU·g-1、3.285×103 CFU·g-1和2.377×103 CFU·g-1;DZSG23喷施小麦穗表面15 d后,穗表面菌群密度仍可达7.146×103 CFU·g-1。此外,诱导系统抗性(ISR)信号通路研究表明,拮抗菌DZSG23可以诱导 PR-1和 AOS基因的上调表达,表明拮抗菌DZSG23引入小麦后可诱导小麦的水杨酸(SA)和茉莉酸(JA)信号通路,增强其抗病性。
In our previous work, a strain of endophytic bacteria Bacillus subtilis DZSG23 was isolated from the leaves of Eucommia ulmoides Oliv, which could effectively control the wheat scab. This study was carried out to explicit the resistance mechanism of endophytic bacteria DZSG23 against wheat scab.The colonization property of DZSG23 in wheat was analysed by antibiotic label method, then the expression of PR-1, AOS, ACOI, ERF and SAM genes in wheat treated with DZSG23 at different growth stages were detected by quantitative realtime PCR. The results indicated that DZSG23 could successfully colonize wheat plant at seedling stage and surface of the spike. At the 34 d after inoculation with DZSG23 by pouring, the colonization of DZSG23 in roots, stems and leaves of wheat plants at seedling stage reached 1.437×106 CFU·g-1, 3.285×103 CFU·g-1 and 2.377×103 CFU·g-1, respectively. After 15 days of inoculation with DZSG23 strain by spraying on the surface of spikes, the surface microbial density of spike tissue still reached 7.146×103 CFU·g-1. Expression of defense response genes PR-1 and AOS in wheat spike treated with DZSG23 were significantly higher than those of normal control groups at different growth stages, showing DZSG23 could induce systemic response through SA-and JA-dependent signaling pathways and enhance its disease resistance.
赤霉病属于真菌病害, 病原菌为镰孢属禾谷镰刀菌(Fusarium graminearum Schw.), 严重威胁到小麦的安全生产。随着我国农业生产中免耕制度、作物秸秆还田技术的推广、化肥用量的增加, 以及小麦品种抗性能力的降低或丧失, 赤霉病在小麦生产中的发生程度逐渐加重。近些年关于植物内生菌在农作物病害中的防治研究较多[1, 2]。研究表明, 内生菌自身及其次生代谢产物可对宿主植物的生长发育产生较好的促进作用[3, 4], 有助于宿主植物抗逆、抗病虫能力的提高[5, 6], 与宿主植物之间形成协同进化、互惠共生的关系。由此可知, 在植物病害的防治中将内生菌作为生防菌具有可行性, 可以增强植物对病原菌的抗性[7, 8, 9]。诱导植物对病原菌产生抗性是一种重要的抗病方式, 在植物病害防治研究中已经有大量的相关报道[10, 11, 12, 13]。水杨酸通路(SA)、茉莉酸通路(JA)和乙烯通路(ET)是植物防御反应过程中的3种信号通路, 生防菌可以通过触发这些信号通路使植物产生系统抗性[10], 其中, PR抗病蛋白与SA信号途径相关, 丙二烯氧化物合酶(AOS)与JA信号途径相关, 而ACC氧化酶(ACOI)、S-腺苷甲硫氨酸脱羧酶(SAM)和转录因子(ERF)则与ET信号途径相关。
在前期研究中, 本课题组从杜仲(采集于安徽合肥地区)叶片的组织中分离得到1株内生细菌枯草芽孢杆菌DZSG23(Bacillus subtilis DZSG23, NCBI登录号 MH267201), 通过在小麦赤霉病防治中的应用, 证明此菌可以较好地防控小麦赤霉病[11]。因此, 在前期研究的基础上, 本研究选择小麦赤霉病菌作为靶标, 通过抗生素标记法对生防菌DZSG23进行抗性标记, 分析其在小麦植株中的定殖动态; 选用SA通路、JA通路和ET通路的相关基因PR-1、AOS、ACOI、ERF和SAM, 对共生互作体系中的小麦植株进行抗病相关通路基因的检测, 以进一步地阐明生防枯草芽孢杆菌DZSG23诱导小麦植株对赤霉病产生抗性的分子机理。研究结果不仅可为生防菌与植物抗病机制之间关系的深入研究提供理论基础, 还可以对开展小麦赤霉病的生物防治提供应用指导, 在理论与实践上均有重要意义。
供试的小麦品种为安农1314; 病原菌为小麦赤霉病菌(Fusarium graminearum), 来源于安徽农业大学植物保护学院病理教研室。培养基为牛肉膏蛋白胨培养基(NA), 固体和液体培养基配置方法与配方参照文献[11, 12]。试验中用到的抗生素包括卡那霉素(kanamycin, Kan)和利福平(rifampin, Rif)。
1.2.1 芽孢杆菌DZSG23的抗生素标记
选择200 μ g· mL-1 Kan、20 μ g· mL-1 Rif对芽孢杆菌DZSG23开展双抗药性标记, 具体方法参照苏博等[12]的方法。以生长稳定、菌落形态和生长曲线稳定、抑菌作用稳定等为指标筛选双抗标记菌株DZSG23Kan, Rif。
1.2.2 抗药菌株DZSG23Kan, Rif遗传稳定性试验
将获得的抗性菌株DZSG23Kan, Rif接种在未添加抗生素的NA培养基上, 继代培养10代后接种到添加抗生素的NA培养基上, 继代培养10代; 然后分别检测DZSG23Kan, Rif在添加抗生素和未添加抗生素的NA培养基上的细菌含量, 比较其抗药性水平差异。选择平板对峙法检测DZSG23Kan, Rif菌株和DZSG23菌株对禾谷镰孢的抑菌活性, 各处理重复3次。
1.2.3 抗药菌株DZSG23Kan, Rif在小麦苗期定殖量的测定
在NA液体培养基中添加200 μ g· mL-1 Kan、20 μ g· mL-1 Rif, 接入DZSG23Kan, Rif, 置于37 ℃、200 r· min-1的摇床上培养24 h, 待菌液中浓度达到1× 106 CFU· mL-1左右时备用。供试小麦种子催芽24 h, 选择露白情况一致的种子按照如下设计要求开展试验:
无菌水处理(CK):随机选择露白情况一致的种子播种在温室花盆中, 每个花盆统一播种5粒, 并浇入提前灭菌冷却的蒸馏水(50 mL· 盆-1), 做好标记。
灭菌NA液体培养基处理(NA):随机选择露白情况一致的种子播种在温室花盆中, 每个花盆统一播种5粒, 并浇入提前灭菌冷却的NA液体培养基(50 mL· 盆-1), 做好标记。
抗药菌株DZSG23Kan, Rif处理(S):随机选择露白情况一致的种子在抗药菌株DZSG23Kan, Rif的菌悬液中浸泡5 h, 捞出播种在温室花盆中(每个花盆播种5粒), 并浇入提前灭菌冷却的NA液体培养基(50 mL· 盆-1), 做好标记。
播种后的第7、10、15、18、22、27、34天, 分别在每个处理中取3株长势一致的小麦植株, 分离根际的土壤进行称量, 加入适量的无菌水混合均匀, 置于37 ℃、200 r· min-1摇床中培养20 min后静置一段时间, 取上清液进行梯度稀释, 分别吸10-4、10-5稀释液100 μ L涂布于添加抗生素的NA固体培养基上, 2种稀释液均涂布3个平皿作为重复。之后转移到37 ℃培养箱中培养, 24 h后对长出的抗性菌株单菌落进行数量统计, 最后折算出单位质量土壤中的单菌落数。
对上述3个处理的小麦植株进行消毒灭菌, 按照不同的处理将小麦植株的根、茎和叶片分开进行称量, 研磨成浆状, 进行梯度稀释, 分别在10-1、10-2和10-3稀释液中吸取100 μ L涂布于添加抗生素的NA固体培养基上, 每个浓度涂3块平板作为重复。之后转移到37 ℃培养箱中培养, 24 h后对长出抗性菌落的单菌落数进行数量统计, 最后推算出单位质量小麦植株中的单菌落数。为检测小麦植株表面的消毒工作是否彻底, 需要取最后一次漂洗植株的无菌水液在NA固体培养基上涂布, 培养24 h, 观察是否有菌长出。
1.2.4 抗药菌株DZSG23Kan, Rif在小麦穗部定殖量的检测
对小麦种子进行催芽, 24 h后选择露白情况一致的种子在温室花盆中播种并做好标记。每盆随机选择15粒播种, 当小麦植株进入扬花期时按照如下设计开展试验:
空白对照处理(CK1):随机选择长势一致的小麦植株, 用提前进行灭菌处理的NA液体培养液对准穗部喷洒并做好标记, 经过48 h套袋保湿处理后进行正常的肥水管理。
抗药菌株DZSG23Kan, Rif处理(S1):将1× 106 CFU· mL-1左右的DZSG23Kan, Rif培养液对准小麦的穗表面进行均匀喷施, 并做好标记, 经过48 h套袋保湿处理后进入正常的水肥管理。
穗部表面的菌落数检测:分别在菌液喷洒后的0、1、3、5、7、10、15、20、25、30 d随机选择3株长势一致的小麦植株, 在无菌接种台内用无菌水对小麦的穗部表面冲洗2次, 逐级进行梯度稀释, 在10-2、10-3稀释液中分别取100 μ L涂布在添加抗生素的NA固体培养基上, 2个浓度均涂3块平皿作为重复, 最终获得单位质量小麦穗表面抗性菌株定殖的单菌落数。
穗部内部菌落检测:对上述麦穗的表面进行消毒, 充分研磨成浆状, 梯度稀释, 从10-2、10-3稀释液中分别取100 μ L涂布在添加抗生素的NA固体培养基上, 每个浓度涂3块平皿作为重复, 最终获得单位质量小麦穗内部抗性菌株定殖的单菌落数。
1.2.5 拮抗菌株诱导小麦系统抗性的研究
试验设2个处理组, 分别为1× 106 CFU· mL-1左右的拮抗菌DZSG23、分生孢子浓度1× 105 mL-1左右的小麦赤霉病菌(标记为B)。当小麦进入到抽穗扬花期后按照试验的2个处理要求对准小麦穗部喷施, 并用无菌NA液体培养基对准小麦穗部喷洒作为对照处理。喷施后第0、12、24、36、48和72 h对各处理组的小麦穗部进行取样, 经过液氮快速冷冻后转移到-80 ℃冰箱中保存、备用。选择多糖多酚植物总RNA提取试剂盒提取各处理的麦穗RNA, 每个处理重复3次。PCR扩增引物序列见表1。
| 表1 实时荧光定量引物序列 Table 1 Primers used for quantitative polymerase chain reaction |
数据分析方法采用DPS软件中的Duncan新复极差法等。
采用抗生素标记法获得1株双抗菌株DZSG23Kan, Rif, 对此菌株开展了遗传稳定性试验。在含有抗生素和不含抗生素的2种NA固体培养基上, DZSG23Kan, Rif菌株在生长数量上差异不明显, 长势上无明显变化。DZSG23Kan, Rif菌株和原始菌株对禾谷镰孢的平板对峙试验结果见图1。原始菌株对禾谷镰孢的抑菌率为69.04%, DZSG23Kan, Rif菌株的抑菌率为68.42%, 两者没有明显差别。由此可知, 突变菌株DZSG23Kan, Rif抗性稳定, 可继续开展后续的定殖试验研究。
采用稀释涂布平板法研究芽孢杆菌DZSG23在小麦根际土壤的定殖情况, 结果如图2所示。
由试验结果可知, 添加灭菌NA液体培养基处理组和无菌水处理组(CK)相比, 根际土壤中的细菌数量无明显差别, 说明, NA液体培养基对苗期小麦根部的处理对小麦植株中的细菌数量变化无影响。抗药菌株DZSG23Kan, Rif灌根处理苗期小麦根部, 其在小麦根际土壤中的动态变化如图2-A所示, DZSG23Kan, Rif菌株的数量随着时间的推移出现先下降再上升的趋势, 当接种时间达到第27天时, 每g土壤中的DZSG23Kan, Rif菌株数量最高, 达到5.76× 106 CFU· g-1后逐渐下降。究其原因可能是将DZSG23Kan, Rif菌株接种至根际土壤后, 与根际微生物在空间位点和营养物质之间形成竞争以维持自身的生长繁殖, 刚开始菌株的数量出现下降的趋势, 当DZSG23Kan, Rif菌株适应了根际土壤的环境并占据空间位点后, 菌株数量出现上升的趋势。
采用稀释涂布平板法研究小麦苗期DZSG23Kan, Rif菌株的定殖情况, 将小麦苗分为根、茎、叶3个部分检测DZSG23Kan, Rif菌株的定殖情况。在小麦根部(图2-B), 前期DZSG23Kan, Rif菌株数量呈现缓慢增长的趋势; 随着DZSG23Kan, Rif菌株在小麦体内移动, 根部的DZSG23Kan, Rif菌株数量减少, 茎部的DZSG23Kan, Rif菌株数量开始增多(图2-C), 并呈现缓慢增长的趋势; 随着时间推移, 茎部的DZSG23Kan, Rif菌株向叶部移动, 叶部的DZSG23Kan, Rif菌株数量开始增多(图2-D)。处理时间达到18 d后, DZSG23Kan, Rif菌株适应了小麦体内的生长环境, 小麦根部、茎部和叶部的细菌数量均呈现上升趋势; 处理时间达到34 d时, 根部的DZSG23Kan, Rif菌株达到1.437× 106 CFU· g-1, 茎部的DZSG23Kan, Rif菌株达到3.285× 103 CFU· g-1, 叶部的DZSG23Kan, Rif菌株达到2.377× 103 CFU· g-1。
采用稀释涂布平板法研究芽孢杆菌DZSG23在小麦穗部的定殖情况, 穗部定殖检测分为麦穗表面菌落数检测和麦穗内部菌落数检测。对麦穗表面的定殖检测结果如图3所示, 喷施DZSG23Kan, Rif菌悬液后抗性菌株在麦穗表面的菌落数量呈先降低再上升的趋势。在接种抗性菌株第15天, 麦穗中DZSG23Kan, Rif菌株的菌群密度达到最高, 为7.146× 103 CFU· g-1, 之后逐渐下降并趋于稳定。究其原因可能是将DZSG23Kan, Rif菌株接种至麦穗表面后需要适应自然环境和穗部环境, 刚开始菌株的数量表现出下降的趋势; 当DZSG23Kan, Rif菌株适应了麦穗表面环境和自然环境后, 菌株的数量表现出上升趋势。
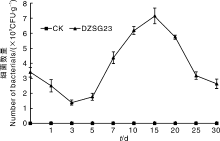 | 图3 DZSG23Kan, Rif在小麦穗表面的定殖动态Fig.3 Colonization dynamics of mutant strain DZSG23 on the surface of wheat ear |
通过研究DZSG23Kan, Rif菌株在穗内部的定殖情况发现, 在接种抗性菌株后的麦穗内部没有检测到DZSG23Kan, Rif菌株, 可能是麦穗表面有坚硬的颖壳, DZSG23Kan, Rif菌株无法穿透颖壳进入种子, 只能定殖于麦穗表面的颖壳上。
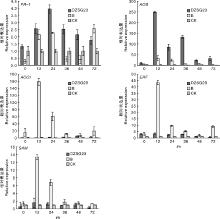
在前期拮抗菌株田间小区试验的基础上, 选取5个基因(PR-1、AOS、ACOI、ERF和SAM)开展拮抗菌株DZSG23诱导小麦植株抗病信号通路研究, 结果如图4所示。芽孢杆菌DZSG23处理小麦24 h后, PR-1基因的表达水平与对照相比上调了3.95倍, 随后PR-1的表达水平虽然逐步降低, 但依旧高于对照。与此同时, AOS基因的荧光定量结果显示, 经芽孢杆菌DZSG23处理的小麦植株, 接种后0 h开始, AOS的表达水平明显上调, 在第12 h达到最高, 为对照处理组的249.35倍。此外, 检测分析ACOI、ERF和SAM基因时, 发现拮抗菌处理组的上述3种基因表达水平均明显低于病原菌处理组。由上述结果可知, 将拮抗菌株DZSG23引入小麦穗部可以激活PR-1和AOS基因的表达, 诱导小麦中的水杨酸信号通路和茉莉酸信号通路。
拮抗菌能否在植物体表或者植株体内高效定殖是其能否发挥生防效果的重要前提[13]。刘海洋等[14]研究发现, 甲基营养型芽孢杆菌AL7对棉花黄萎病的盆栽防效达到75%以上, 并且可以在土壤中长期定殖。细菌可以通过植物表面的气孔或者伤口进入植株体内, 因此本研究先对麦粒进行催芽处理, 再进行突变菌株DZSG23菌悬液浸泡处理, 使突变菌株进入小麦体内, 通过对小麦苗期根、茎、叶中突变菌株的数量检测, 发现随着接种后时间的延长和小麦的生长, 突变菌株会从小麦根部缓慢移动至茎和叶中, 苗期小麦接种DZSG23菌株后的第34天, DZSG23在小麦植株的根、茎和叶中的定殖量分别达到1.437× 106、3.285× 103、2.377× 103 CFU· g-1。当根、茎、叶中都存在突变菌株DZSG23时, 突变菌株DZSG23的菌体数量持续上升达到一定浓度, 从而起到发挥生防的效果。对小麦穗表面喷施突变菌株DZSG23后, 突变菌株只能在穗表面定殖而无法进入麦穗内部, 接种第15天时穗表面的菌体数量达到7.146× 103 CFU· g-1, 随后缓慢降低至保持稳定, 而穗内部并没有突变菌株的存在, 可能原因是麦穗表面颖壳坚硬, 突变菌株无法穿透进入到麦穗的内部。此外, 该试验仅对DZSG23在小麦植株中的定殖动态进行了研究, DZSG23拮抗菌灌根处理小麦植株, 会不会对小麦的根系、株高、产量等各项生长指标产生影响, 则有待进一步研究。
目前用来检测生防菌是否在寄主植物体内定殖的方法主要有抗生素标记法、基因标记法、同位素示踪法、DNA和RNA探针法等[15, 16], 抗生素标记法具有简单、快速、实用、不会改变原始菌株的重要特性等优点, 适合用来跟踪微生物在植株体内的定殖情况。游春平等[17]利用利福平和青霉素抗生素标记了拮抗细菌Bio-d5, 证明了该菌株对香蕉枯萎病具有生防效果, 且在土壤中可以很好地定殖。后续研究中, 该课题组将利用GFP基因标记, 对菌株DZSG23在小麦植株中的定殖动态进行验证补充。
关于芽孢杆菌诱导植物产生系统抗性有较多报道, 如Tan等[18]发现解淀粉芽孢杆菌T-5可以激活水杨酸通路和茉莉酸/乙烯通路, 提高番茄植株对番茄青枯病的抗性。张振华[19]研究发现, 经过生防菌SQR-21、BmJ和203-7处理的黄瓜病变组织中, β -1, 3-葡聚糖酶和几丁质酶活性均有提高。Niu等[20]发现, 蜡质芽孢杆菌AR156可以诱导拟南芥形成SA和JA等信号途径, 对丁香假单孢菌形成的病害产生抗性。该试验在前期已明确DZSG23可以较好地防控小麦赤霉病基础上[11], 选用了SA通路、JA通路和ET通路的相关基因PR-1、AOS、ACOI、ERF和SAM进行荧光定量试验, 发现拮抗菌DZSG23可以激活PR-1和AOS基因的表达, 与此同时, ACOI和ERF基因在小麦植株中表达不明显, 且SAM基因表达呈下调趋势; 表明拮抗菌DZSG23处理小麦植株, 可以诱导小麦植株形成水杨酸和茉莉酸相关抗病通路, 增强小麦对病原菌的抗病性。后续研究中, 计划利用该拮抗菌株开展大田试验, 研究其在田间的生防效果, 为利用该拮抗菌株进行微生物菌剂的研制提供理论基础。
(责任编辑 侯春晓)
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|