作者简介:李戌清(1982—),女,山西原平人,博士,高级农艺师,主要从事植物病害研究。E-mail: xq_li@126.com
浙江省淳安县三叶青叶部病害发生危害严重,对当地三叶青生产造成了巨大的经济损失;明确其病原菌种类与生物学特性,可为病害的有效防控提供理论依据。采用常规组织分离法对病原菌进行分离,利用病原菌形态学、分子系统学(rDNA- ITS、 β-tubulin、 ACT、 gpd、 CaM基因的PCR扩增、序列分析和系统发育树的构建)和致病性测定相结合的方法,将为害三叶青的病原菌鉴定为胶孢炭疽菌( Colletotrichum gloeosporioides);并采用十字交叉法和血球计数板计数法对该菌的生物学特性进行了研究。结果表明:菌株CA-2在20~35 ℃均能生长,最适菌丝生长和产孢的温度均为25 ℃;24 h暗培养最利于菌丝生长和产孢;培养基pH为5.0最利于菌丝生长,而pH为8.0最利于产孢。菌株CA-2能利用多种碳、氮源营养,但存在一定的差异;其中,菌丝在以麦芽糖和山梨醇为碳源、牛肉浸膏为氮源的培养基上生长最快,在以乙醇为碳源、谷氨酰胺为氮源的培养基上最慢;产孢量在以山梨醇为碳源、酵母膏为氮源的培养基上最大,在以甘露醇为碳源、胰蛋白胨为氮源的培养基上最少。
Leaf spot occurred severely in Chun'an city, Zhejiang Province, and caused serious economic losses in local Tetrastigma hemsleyanum production. To clarify the species and biological characteristics of the pathogen caused leaf spot could provide scientific data for the disease effective control. The pathogen was isolated by plate confrontation assay and identified as Colletotrichum gloeosporioides based on combination of morphological characters, molecular data (rDNA- ITS, β-tubulin, ACT, gpd, CaM)and pathogenicity tests. And the biological characteristics determined by crossing and haemocytometer methods showed that the fungus was able to grow at temperature between 20-35 ℃ with an optimum of 25 ℃ for both mycelia growth and sporulation; the continuous darkness was good for both mycelia growth and sporulation; In addition, the optimal pH for mycelia growth and sporulation was 5.0 and 8.0, respectively.There were various kinds of carbohydrates and nitrogen known to provide growth of the fungus. Maltose,sorbitol and yeast were the best carbon and nitrogen source for mycelia growth, respectively, while ethanol and glutamine were the worst, respectively. Sorbitol and yeast were the best carbon and nitrogen source for sporulation, respectively, while mannitol and casein tryptone were the worst, respectively.
三叶青(Tetrastigma hemsleyanum)别名蛇附子、金线吊葫芦、小扁藤等[1, 2], 系葡萄科崖爬藤属三叶崖爬藤的块根, 主要分布于我国浙江、江西、福建、湖北、湖南、广东、广西、四川、贵州、云南等省区的阴湿山坡、山沟、林下[3, 4], 不仅具有抗病毒、抗炎镇痛、护肝等功效, 对小儿高热、支气管炎、百日咳等疾病也有显著疗效[5, 6, 7]。目前三叶青的研究主要集中在栽培、组培快繁、化学成分、药理作用、临床应用、加工技术、质量评价、产地鉴别等方面[8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18], 对其病害的研究鲜有报道。
2019年10月, 作者在浙江省淳安县林下三叶青种植区发现一种严重影响三叶青生长的炭疽病。该病害主要为害三叶青叶部, 发病初期叶面布满褐色圆形病斑, 后逐渐扩展为边缘褐色、中央灰白色且上生黑色小粒点; 病斑处较薄, 易破裂、穿孔; 危害严重时叶片枯死脱落, 给药农造成了巨大经济损失。该病害已然成为影响三叶青产业的重要潜在威胁, 而对其病原菌的准确鉴定是了解病害流行规律和有效防控病害的重要前提。
在相当长的一个阶段, 炭疽菌的鉴定和分类主要采用以自然形态(自然条件下繁殖体的形态学特征)为主、寄主专化性和纯培养特征为辅的方法[19, 20, 21, 22, 23]。但由于炭疽菌属形态学特征具有较强的可变性, 仅以形态学作为唯一的分类标准具有一定的风险[24]。近年来, 随着分子生物学技术的迅猛发展, 学者们将目光越来越多地投入到以DNA为基础的分子系统研究上。与传统分类法相比, 该方法更快捷准确。谭海文等[25]、朱迎迎等[26]、徐波等[27]均以ITS序列作为分类依据成功鉴定了不同作物上分离获得的炭疽菌种类。然而, 随着对炭疽菌研究的不断深入, 学者们发现仅依据ITS序列同源性对炭疽菌分类有一定的错误风险, 而结合β -微管蛋白(β -tubulin)、肌动蛋白(ACT)、3-磷酸甘油醛脱氢酶(gpd)、钙调蛋白(CaM)等基因进行多基因系统分析, 可使分类结果更准确[28]。目前, 炭疽菌的分类主要以传统方法为基础、现代分子生物学方法为辅助相结合进行。吴奉奇[29]以形态学为基础, 结合ITS、β -tubulin、ACT、gpd和CaM五种基因成功鉴定出为害降香黄檀等几种珍贵阔叶树种的炭疽菌为暹罗刺盘孢(C. siamense)和果生刺盘孢(C. fructicola); 朱英芝等[30]通过形态学和ITS、β -tubulin、ACT、gpd和几丁质合成酶(CHSⅠ )多基因系统分析相结合的方法, 将为害广西油茶的炭疽菌鉴定为胶孢炭疽菌(C. gloeosporioides); 廖旺姣等[31]采用形态学结合ITS、β -tubulin和gpd分子系统学分析方法, 成功鉴定出为害土沉香幼苗的炭疽菌为核果炭疽菌(C. fructicola)。本研究结合上述2种方法鉴定了浙江省淳安县三叶青炭疽病病原菌, 并对其生物特性进行了系统研究, 以期为当地三叶青炭疽病的防控和深入研究提供理论依据。
于2019年10月, 在浙江省淳安县林下三叶青种植区, 采集具有典型症状的三叶青叶片, 装于干净的封口采集袋中, 带回实验室, 进行病原菌的分离。
病叶在自来水龙头下充分冲洗干净, 用滤纸吸干。用剪刀剪取病健交界处组织块(约2 mm× 2 mm), 75%乙醇表面消毒约5 s, 无菌水充分冲洗3次, 置于PDA平板上25 ℃培养4 d后, 挑取菌落边缘菌丝到新PDA平板纯化2次。单孢纯化后选择代表性菌株接种于PDA斜面培养基, 置于4℃保存备用。
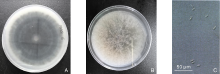
选择3个代表性菌株, 在PDA培养基上于25 ℃培养箱中活化培养4 d, 用直径5 mm打孔器在菌落边缘切取菌碟, 转至新的PDA培养基上; 于25 ℃培养7 d, 挑取菌丝丛置于光学显微镜(LEICA DMI3000B, 德国徕卡)下观察拍摄病原菌的分生孢子形态特征, 并测量50个分生孢子大小。
利用真菌基因组DNA快速抽提试剂盒提取病原菌基因组DNA。rDNA-ITS、β -tubulin、ACT、gpd和CaM序列扩增采用的引物分别为:ITS5(5'-GGAAGTAAAAGTCGTAACAAGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')[32]、Bt2a(5'-GGTAACCAAATCGGTGCTGCTTTC-3')和BT2b(5'-ACCCTCAGTGTAGTGACCCTTGGC-3')[33]、ACT-512F(5'-ATGTGCAAGGCCGGTTTCGC-3')和ACT-783R(5'-TACGAGTCCTTCTGGCCCAT-3')[34]、GDF1(5'-GCCGTCAACGACCCCTTCATTGA-3')和GDR1(5'-GGGTGGAGTCGTACTTGAGCATGT-3')[35]、CMD5(5'-CCGAGTACAAGGARGCCTTC-3')和CMD6(5'-CCGATRGAG GTCATRACGTGG-3')[36]。PCR反应体系(50 μ L)为:10× PCR buffer(含Mg2+)5 μ L、2.5 mmol· L-1dNTP 4 μ L、10 pmol· μ L-1引物各2 μ L、模板DNA 4 μ L、ddH2O 32.5μ L、5 U· μ L-1Taq酶0.5 μ L。PCR扩增程序为:95 ℃预变性5 min; 95 ℃变性45 s, 52 ℃(ITS区)退火45 s, 72 ℃延伸1 min, 35个循环; 72 ℃总延伸10 min。95 ℃预变性5 min; 95 ℃变性1 min, 57 ℃(β -tubulin区)或55 ℃(CaM区)退火1 min, 72 ℃延伸1 min 30 s, 35个循环; 72 ℃延伸10 min。95 ℃预变性5 min; 95 ℃变性30 s, 55 ℃(ACT区)或58 ℃(gpd区)退火30 s, 72 ℃延伸1 min, 35个循环; 72 ℃总延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测后, 送浙江尚亚生物技术有限公司进行序列测定。测序所得序列经DNAstar软件Clustal W程序进行联配(alignment)比较、编辑, 校正后将各基因首尾相连, 用Mega 6.0软件Clustal W程序进行系统发育分析, 用最大似然法(maximum likelihood, ML)构建系统发育树, 用Bootstrap对系统进行检验, 1 000次重复。
选取健康的三叶青嫩叶, 用75%乙醇表面消毒5 s, 用无菌针在待接种部位戳3个小孔。用直径5 mm打孔器从25 ℃培养4 d的PDA平板上切取3个菌株的菌丝块, 菌丝面朝下贴于叶片待接种部位。每张叶片接种1个菌株, 每个菌株接种3张叶片, 置于25 ℃智能人工气候箱中培养, 定期观察并记录叶片发病情况。以接种无菌的PDA块为对照。待发病症状明显后, 从发病叶片的病健交界处再分离病原菌。
1.6.1 温度对菌丝生长和产孢量的影响
用直径5 mm打孔器从预培养4 d的病原菌菌落边缘打取菌碟并接种到PDA平板中央, 分别置于15、20、25、28、30、35 ℃倒置培养, 每处理4次重复, 3 d后用直尺十字交叉法测量菌落生长直径, 7 d后用10 mL ddH2O洗下孢子, 用血球计数板计数法测定产孢量。
1.6.2 光照对菌丝生长和产孢量的影响
接种方法同上, 将PDA平板分别置于24 h光照、12 h光照12 h黑暗、24 h黑暗的条件下, 25 ℃倒置培养, 每处理4次重复。菌落生长直径的测量和产孢量的测定方法同1.6.1节。
1.6.3 pH对菌丝生长和产孢量的影响
将配制好的PDA培养基高压灭菌, 在热凝固倒平板前分别用0.1 mol· L-1HCl或0.1 mol· L-1NaOH调节培养基pH至4.0、5.0、6.0、7.0、8.0、9.0, 即得到不同pH的PDA培养基[37]。接种方法同上, 25 ℃倒置培养, 每处理4次重复, 菌落生长直径的测量和产孢量的测定方法同1.6.1节。
1.6.4 碳源对菌丝生长和产孢量的影响
以查氏培养基(KNO3 2.00 g、K2HPO4 1.00 g、KCl 0.50 g、MgSO4· 7H2O 0.50 g、FeSO4 0.01 g、蔗糖30.00 g, 加水定容至1 000 mL)为基础培养基, 分别用等量半乳糖、可溶性淀粉、甘露醇、果糖、麦芽糖、葡萄糖、山梨醇、乙醇替换基础培养基中的蔗糖。接种方法同上, 25 ℃倒置培养, 每处理4次重复, 菌落生长直径的测量和产孢量的测定方法同1.6.1节。
1.6.5 氮源对菌丝生长和产孢量的影响
以查氏培养基为基础培养基, 分别用等量甘氨酸、谷氨酰胺、脯氨酸、酵母膏、硫酸铵、牛肉浸膏、胰蛋白胨、氯化铵替换基础培养基中的硝酸钾。接种方法同上, 25 ℃倒置培养, 每处理4次重复, 菌落生长直径的测量和产孢量的测定方法同1.6.1节。
在上述培养条件下, 3个菌株的菌落均呈圆形, 地毯状平铺, 边缘整齐。菌落正面灰白色、背面灰黑色。菌丝为灰白色至深灰色絮状。分生孢子梗无色至褐色, 卵圆形或棍棒形。分生孢子圆柱形、单胞, 两端钝圆, 内含2~3个油球, 大小为(11.0~14.3)μ m× (3.7~5.2)μ m。根据形态学特征, 将3个菌株初步鉴定为胶孢炭疽菌(C. gloeosporioides)。
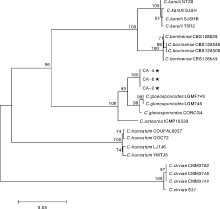
由图2可知, 3个供试菌株和20个GenBank数据库中下载获得的炭疽菌菌株(表1)聚集在6个大的分支上, 所有同种炭疽菌的不同菌株均独立成群, 聚集在同一分支上, 且与其他分支具有明显的进化距离, 各分支之间的支持率均在93%以上。其中, 三叶青炭疽病病原菌与其他3个不同来源的胶孢炭疽菌聚集在一起, 亲缘关系最近, 且与其他炭疽菌种明显在不同分支上。多基因系统学分析结果进一步证实了浙江省淳安县三叶青炭疽病病原菌为胶孢炭疽菌(C. gloeosporioides)。
| 表1 从GenBank数据库中下载的炭疽菌序列 Table 1 Sequences got from GenBank database |
人工接种试验显示, 离体嫩叶接种2~3 d后开始出现组织坏死, 其症状与自然发病症状基本一致(图3)。取接种发病三叶青叶片病健交界处组织进行再分离, 所得病菌形态与自然田间病株上分离的形态学特征相同, 而对照无任何症状。证实获得的分离菌株是三叶青炭疽病的病原菌。
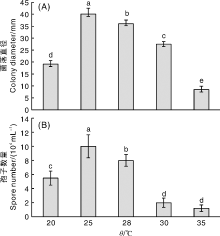
胶孢炭疽菌CA-2在20~35 ℃均能生长, 在25 ℃菌丝生长最快, 菌落直径达40.0 mm, 显著(P< 0.05)高于其他温度条件下的菌落直径。在20~35 ℃均能产孢, 在25 ℃产孢量最大, 达10.0× 104mL-1, 显著(P< 0.05)高于其他温度条件下的产孢量。即菌株CA-2最适菌丝生长和产孢的温度均为25 ℃(图4)。
菌株CA-2在不同光照条件下生长速率不同, 其中在24 h黑暗条件下菌丝生长最快, 菌落直径达40.0 mm, 略快于12 h光照12 h黑暗条件下的38.6 mm, 两者之间差异不显著, 但均显著快于24 h光条件。在24 h暗条件下产孢量最大, 为10.0× 104 mL-1, 显著高于12 h光照12 h黑暗的0.8× 104 mL-1和24 h光照条件的0.5× 104 mL-1。表明黑暗环境有利于菌株CA-2菌丝生长和产孢, 随着暗培养时间的延长菌丝生长增快、产孢量增多(图5)。
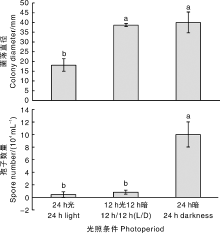 | 图5 光照条件对菌株CA-2菌丝生长与产孢量的影响Fig.5 Effect of photoperiod on mycelia growth and spores production of strain CA-2 |
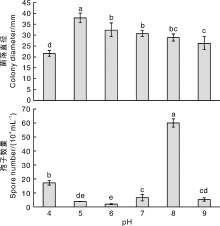
图6表明, 不同pH条件对菌株CA-2生长速率的影响不同, 其中pH 5.0时菌丝生长最快, 菌落直径为37.9 mm, pH 4.0时菌丝生长最慢, 为21.6 mm, 均与其他pH条件下的菌落生长速率差异显著(pH 6.0 32.4 mm、pH 7.0 30.8 mm、pH 8.0 28.8 mm、pH 9.0 26.3 mm); pH 8.0时产孢量最大, 达60.0× 104 mL-1, pH 4.0时次之, 为17.3× 104 mL-1, 均显著高于其他pH条件下的产孢量(pH 7.0 6.7× 104 mL-1、pH 9.0 5.3× 104 mL-1、pH 5.0 4.0× 104 mL-1、pH 6.0 2.0× 104 mL-1)。表明在供试pH范围内, 随着pH值的升高, 菌丝生长速率先急剧升高而后缓慢下降, pH 5.0是菌株CA-2菌丝生长的最适pH; 而产孢量在供试pH范围内呈先急剧下降再急剧增加再急剧下降的趋势, pH 8.0为其产孢的最适pH。
由图7可知, 菌株CA-2在9种供试碳源培养基上均能生长, 以麦芽糖和山梨醇为碳源的培养基上菌丝生长最快, 菌落直径均为27.0 mm; 以乙醇为碳源的培养基上菌丝生长最慢, 为13.5 mm, 显著(P< 0.05)低于以葡萄糖、果糖、半乳糖和甘露醇为碳源的培养基。以山梨醇为碳源的培养基上产孢量最大, 达19.0× 104 mL-1; 以半乳糖为碳源的培养基次之, 为9.6× 104 mL-1; 再次是以果糖为碳源的培养基, 为3.5× 104 mL-1, 均显著多于其他碳源培养基。因此, 麦芽糖和山梨醇为菌株CA-2菌丝生长的最适碳源, 而山梨醇同时也是最适其产孢的碳源。
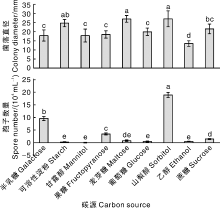 | 图7 不同碳源对菌株CA-2菌丝生长与产孢量的影响Fig.7 Effect of carbon source on mycelia growth and spores production of strain CA-2 |
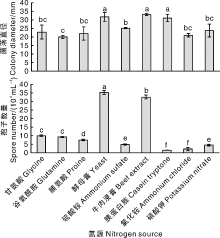
菌株CA-2在9种供试氮源培养基上均能生长, 其中以牛肉浸膏培养基上菌丝生长最快, 菌落直径为33.1 mm, 其次是以酵母膏和胰蛋白胨(分别为31.7 mm和31.1 mm)为氮源的培养基, 再次是硫酸铵、硝酸钾、甘氨酸、脯氨酸和氯化铵(分别为25.2 mm、23.7 mm、22.8 mm、22.0 mm和21.0 mm), 以谷氨酰胺为氮源的培养基上菌落生长最慢, 为20.0 mm。在酵母膏培养基上产孢量最大, 达35.3× 104 mL-1; 以硫酸铵为氮源的培养基次之, 为32.7× 104 mL-1; 再次为以甘氨酸、谷氨酰胺、脯氨酸、硫酸铵和硝酸钾为氮源的培养基, 分别为10.0× 104、9.3× 104、7.5× 104、4.8× 104、4.5× 104 mL-1; 氯化铵和胰蛋白胨产孢量最少, 分别为2.2× 104、1.5× 104 mL-1(图8)。综上, 菌株CA-2最适菌丝生长的氮源为牛肉浸膏, 最适产孢的氮源为酵母膏。
近年来, 炭疽菌引起我国中药材炭疽病的发生时有报道。如, 胶孢炭疽菌(C. gloeosporiodes)可为害米槁、雷公藤、山牵牛、铁皮石斛、地榆、猫豆、阔叶十大功劳等, 使叶片或植株枯死, 影响品质和产量[25, 38, 39, 40, 41, 42, 43, 44]; 人参炭疽菌(C. panacicola)和胶孢炭疽菌(C. gloeosporiodes)为害田七, 引起叶片穿孔、褐化[45]; 黄麻炭疽菌(C. corchorum)为害黄麻, 影响其纤维产量和品质[46]; 束状炭疽菌(C. dematium)侵染当归, 使叶片或植株枯死[47]。但尚未见炭疽菌引起三叶青炭疽病发生为害的系统报道。本研究在浙江省淳安县林下三叶青种植区多点采样, 分离获得严重为害其叶部生长的病害标样12个, 通过对其中3个代表性菌株进行形态学、分子系统学和致病性测定, 明确了胶孢炭疽菌(C. gloeosporiodes)为引起当地三叶青炭疽病的病原菌, 这是三叶青炭疽病病原菌在我国的首次系统研究和报道。由于胶孢炭疽菌(C. gloeosporiodes)在世界上分布极广, 在致病性、寄主特异性和遗传同质性等方面可分成许多亚种, 属多形态种, 故以形态学鉴定为基础, 结合分子系统学研究, 如rDNA-ITS、β -tubulin、ACT、gpd和CaM等多个基因进行系统发育分析, 可极大地提高鉴定工作的可靠性[28, 48]。
胶孢炭疽菌的适应性也极强。本研究发现, 三叶青胶孢炭疽菌(C. gloeosporiodes)在20~35 ℃均能生长, 25 ℃是菌丝生长和产孢的最适温度, 低于广西油茶和阔叶十大功劳株系(28 ℃)[30, 49]、云南墨兰株系(菌丝生长适宜温度30 ℃, 产孢适宜温度35 ℃)[50]; 其生长喜暗环境, 在24 h暗条件下菌丝生长最快、产孢最多, 这与云南墨兰株系喜24 h暗或12 h光12 h暗的结论基本一致, 但与广西十大功劳株系菌丝生长喜24 h光、产孢喜24 h暗的结论有一定差异[49, 50]。三叶青胶孢炭疽菌在pH 4.0~9.0均能生长, 最适菌丝生长的pH为5.0, 最适产孢的pH为8.0, 这与谭海文等[49]认为酸性条件更利于该菌菌丝生长的结论一致, 这说明不同来源的同种病原菌在生物学特性方面存在一定的差异, 究其原因可能与菌株寄主、地理来源、生态适应性等差异有关。此外, 营养物质对病原菌不同株系生长的影响也不尽相同。谭海文等[49]认为, 阔叶十大功劳株系在以蔗糖和麦芽糖为碳源、硝酸钾为氮源的培养基上菌丝生长最快, 在以葡萄糖为碳源、硝酸钾为氮源的培养基上产孢最多; 杨丽芬等[50]认为, 云南墨兰株系菌丝生长的最适碳氮源分别为甘露醇和甘氨酸, 产孢的最适碳氮源分别为麦芽糖和蛋白胨; 姚锦爱等[51]认为, 硝酸钾可抑制福建建兰株系菌丝的生长; 朱英芝等[30]认为, 适合广西油茶株系菌丝生长的碳源为菊糖、D-果糖、葡萄糖, 适合产孢的碳源为菊糖、可溶性淀粉、阿拉伯树胶粉, 酵母粉和牛肉膏为适合菌丝生长和产孢的氮源, 而硝酸铵和硫酸铵对菌丝生长和产孢均有抑制作用。本研究的三叶青株系在以麦芽糖和山梨醇为碳源、牛肉浸膏为氮源的培养基上菌丝生长最快, 在以山梨醇为碳源、酵母膏为氮源的培养基上产孢最多, 而氯化铵对菌丝生长和产孢均有一定的抑制作用, 这可能与菌株差异、采集地理或生理差异、所选择的碳源、氮源等不同有关。
为害浙江省淳安县三叶青叶部的病原菌为胶孢炭疽菌(C. gloeosporiodes), 其菌丝生长和产孢的最适温为25℃, 光照条件为24 h黑暗; 菌丝生长的最适pH为5.0, 最适碳源为麦芽糖和山梨醇, 最适氮源为牛肉浸膏; 产孢的最适pH为8.0, 最适碳源为山梨醇, 最适氮源为酵母膏; 氯化铵对菌丝生长和产孢均有一定的抑制作用。所以, 在三叶青日常栽培管理中, 药农应尽量避开上述条件。同时, 在栽培中, 尽量选用抗耐病种苗, 进行合理密植, 及时清除病残体, 叶面喷施氯化铵, 并在病害发生时及时轮换施用唑类杀菌剂(丙环唑、三唑酮、三唑醇)、甲氧基丙烯酸酯类杀菌剂(醚菌酯、嘧菌酯、嘧菌胺)、硫代氨基甲酸酯类杀菌剂(甲基硫菌灵、多菌灵)或抗生素类杀菌剂(中生菌素)等进行人工干预。
(责任编辑 侯春晓)
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|