作者简介:石婧(1994—),女,新疆昌吉人,硕士研究生,主要从事绿洲农业生态研究。E-mail:15739333226@163.com
为探究不同耐盐性棉花品种幼苗对盐胁迫的生理响应特征,以棉花耐盐品种中9806和盐敏感品种中S9612为材料,采用水培法,设置4个NaCl浓度梯度(0、100、150、200 mmol·L-1)来模拟不同强度盐胁迫条件。结果表明:随着盐浓度的增加,各棉花品种的可溶性糖(SS)含量上升,抗氧化酶活性呈先上升后下降的趋势;盐处理下,耐盐品种可溶性蛋白(SP)、脯氨酸(Pro)含量增加量高于盐敏感品种;S1处理(100 mmol·L-1 NaCl)中盐敏感品种丙二醛积累量较低,但在S2和S3处理(150、200 mmol·L-1 NaCl)中,耐盐品种丙二醛含量增幅(5.35%~6.83%)低于盐敏感品种(36.93%~77.34%),超氧化物歧化酶(SOD)、过氧化物酶(POD)活性增加量较大;低盐浓度(S1处理)下,盐敏感品种地上部分能够保持较少的Na+,高盐浓度(S2和S3处理)下,耐盐品种根中Na+增加量小于盐敏感品种,茎中K+、K+/Na+较高。综上表明,耐盐品种棉花通过增强渗透调节,提高抗氧化酶活性缓解膜脂过氧化,维持较高K+/Na+,从而提高棉花幼苗的耐盐性。
To study the physiological response characteristics of cotton seedlings with different salt tolerance under salt stress, the salt-tolerant variety Zhong 9806 and salt-sensitive variety Zhong S9612 were used as test materials, four different concentrations (0, 100, 150, 200 mmol·L-1) of NaCl were set to simulate different conditions of salt stress by hydroponic method. The results showed that with the increase of salt concentration, soluble sugar content of each cotton variety increased, and the antioxidant enzyme activity increased first and then decreased. Under salt treatment, the soluble protein and proline content of salt-tolerant cultivar increased more than those of salt-sensitive cultivar; Under S1 treatment (100 mmol·L-1 NaCl), the accumulation of malondialdehyde content was lower in salt-sensitive cultivar, but under S2 and S3 treatments (150, 200 mmol·L-1 NaCl), the increase of malondialdehyde content of salt-tolerant cultivar (5.35%-6.83%) was lower than those of salt-sensitive cultivar (36.93%-77.34%), and the activities of superoxide dismutase and peroxidase increased greatly. Under low salt concentration stress, the above-ground part of the salt-sensitive cultivar could maintain less Na+, and under high salt concentration stress, the increase of Na+ in the root of salt-tolerant variety was less than that of the salt-sensitive cultivar, and K+, K+/Na+ in the stems were relatively high. In summary, it had been shown that under salt stress, salt-tolerant cultivars of cotton could increase the content of osmoregulation substance, increase the activity of antioxidant enzymes to relieve membrane lipid peroxidation, and maintain a higher K+/Na+ ratio, thereby improving salt tolerance of seedlings.
据不完全统计, 我国盐渍化土壤面积占现有耕地面积的10%[1], 新疆作为我国最重要的棉花生产基地, 其现有耕地的31.1%受到盐渍化危害[2]。盐分是一种主要的环境胁迫因素, 影响作物的生长发育和产量[3]。在盐胁迫下, 植株体内的Na+是主要的毒害因子[4], 主要表现在渗透胁迫、离子毒害等方面[5]。植物通过渗透调节来维持细胞代谢活动, 通过增强抗氧化系统来应对渗透胁迫[6, 7]。胞质中过多的Na+对植物体内微量营养元素、酶活性、新陈代谢和光合作用有负面影响[8, 9]。维持Na+稳态对于植株是重要的, 但并不是唯一有效的耐盐手段, 外部高Na+的环境往往会降低对K+的吸收, 还会破坏植株体内稳定的K+/Na+[10, 11], 因此, 细胞为了维持自身平衡会有一定保留K+的能力, 维持胞质K+的稳态[12]。同样, 保持组织内较高的K+/Na+平衡比单一地维持较低的Na+更重要, 这也是耐盐的重要机制之一[13]。
作为重要的经济作物, 棉花幼苗对盐分比较敏感, 被广泛用作盐碱地的先锋作物[14, 15]。研究棉花在盐胁迫下的自我保护机制是耐盐棉花育种的重要手段之一。目前已有许多关于棉花耐盐性的研究, 报道了棉花的部分耐盐机理, 但这些研究的测定方法和得出结论不尽相同[16, 17], 仍存在不同争议, 一定程度上给棉花耐盐育种造成了诸多困难。本研究以耐盐型和盐敏感型品种棉花幼苗为材料, 研究盐胁迫对棉花幼苗渗透物质、抗氧化酶活性, 以及Na+、K+含量的影响, 探究盐胁迫对棉花幼苗生理特性的影响, 从渗透调节、抗氧化系统, 以及离子平衡角度探究棉花耐盐的机制, 为制定盐碱地棉花耐盐品种的选育指标提供理论依据。
供试棉花品种为中9806(耐盐品种)和中S9612(盐敏感品种), 品种和耐盐程度由中国农业科学院棉花研究所提供。
试验于2019年3月在石河子大学绿洲生态实验室进行。将棉花种子用质量体积分数0.1% HgCl2消毒5 min, 用无菌水冲洗, 再用无菌水浸种12 h, 然后置于垫有双层湿润滤纸的发芽盒(规格220 mm× 170 mm)上催芽, 待棉花子叶平展后, 选择生长状况一致的幼苗, 用海绵条固定在装有1/2 Hoagland营养液的水培盒(6孔)内, 生长2 d后换为Hoagland营养液, 并放置于光照培养箱内。培养条件如下:光照周期16 h/8 h (L/D), 光合有效辐射400 μ mol· m-2· s-1, 培养温度(25± 0.5) ℃, 空气相对湿度60%~70%。
待棉花幼苗生长至四叶一心时, 进行NaCl溶液处理, 设置4个胁迫水平, NaCl浓度分别记为0(对照, CK)、100 mmol· L-1(S1)、150 mmol· L-1(S2)和200 mmol· L-1(S3), 每处理2盒, 3次重复。为防止一次性加入盐溶液导致棉株死亡, 每隔6 h在营养液中加入50 mmol· L-1 NaCl, 直至营养液中NaCl达到相应的处理浓度。处理7 d进行生理指标测定, 培养期间营养液每5 d更换1次。
1.3.1 生理指标
各处理分别取代表性棉株12株, 将棉株倒3叶保存在液氮中, 用于生理指标的测定。采用硫代巴比妥酸比色法测定丙二醛的含量, 采用考马斯亮蓝G-250染色法测定可溶性蛋白质含量, 采用茚三酮比色法测定脯氨酸含量, 采用蒽酮比色法测定可溶性糖含量, 采用氮蓝四唑光还原法测定超氧化物歧化酶活性, 采用愈创木酚-过氧化氢法测定过氧化物酶活性, 采用紫外吸收法测定过氧化氢酶活性。以上指标均参考植物生理学实验指导书进行测定[18]。
1.3.2 离子的测定
各处理分别取代表性棉株6株, 分叶、茎、根3部分, 清洗后用吸水纸吸干水分装入牛皮纸袋内, 105 ℃杀青30 min, 80 ℃烘干至恒质量。称取烘干粉碎后的棉花叶片0.01 g, 置于马弗炉中(550 ℃)进行灰化, 用离子水定容至100 mL后, 用离子色谱仪测定Na+、K+含量[19], 并计算K+/Na+。
利用Microsoft Excel 2017软件对数据进行计算处理与绘图, 用SPSS 20.0软件对数据进行统计分析, 采用单因素方差分析进行各数据组间的差异显著性检验。
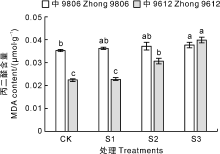
随着NaCl浓度的升高, 棉花叶片丙二醛(MDA)含量逐渐升高, 均在S3处理中叶片MDA含量最高(图1)。耐盐品种中9806的叶片MDA含量在S1和S2处理中与对照组(CK)无显著差异(P> 0.05), 在S3处理中显著(P< 0.05)高于CK, S3处理是CK的1.07倍。盐敏感品种中S9612叶片MDA含量在S1处理中与CK无显著差异(P> 0.05), 在S2和S3处理中均显著(P< 0.05)高于CK, 分别是CK的1.37倍和1.77倍。
由图2-A可知, 随着NaCl浓度的升高, 耐盐棉花品种中9806叶片的可溶性蛋白含量显著(P< 0.05)升高; 盐敏感品种中S9612叶片的可溶性蛋白含量在S1和S3处理中显著(P< 0.05)高于CK, 而在S2处理中与CK无显著差异(P> 0.05)。与盐敏感品种中S9612相比, 耐盐品种中9807叶片的可溶性蛋白含量在盐处理下增幅较大, 2个品种叶片可溶性蛋白含量均在S3处理中最高。
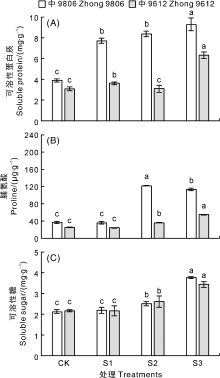 | 图2 盐胁迫对棉花幼苗叶片渗透调节物质的影响Fig.2 Effects of salt stress on osmotic regulating substances in cotton seedling leaves |
随着NaCl浓度的升高, 耐盐品种和盐敏感品种棉花叶片中脯氨酸(Pro)含量变化存在差异(图2-B)。耐盐品种中9806叶片中Pro含量先升高后降低, 在S1处理中与CK无显著差异(P> 0.05), 在S2处理中含量升至最高且显著(P< 0.05)高于CK, 是CK的3.28倍, 盐浓度继续增加, 叶片中的Pro含量下降, 但仍显著(P< 0.05)高于CK, 是CK的3.05倍。盐敏感品种中S9612叶片中Pro含量逐渐升高, 在S1处理中与CK无显著差异(P> 0.05), S2和S3处理中均较CK显著(P> 0.05)增加, 分别是CK的1.49倍和2.25倍。S2和S3处理中, 耐盐品种中9806叶片脯氨酸含量较CK增幅大于盐敏感品种中S9612。
随着NaCl浓度的升高, 供试棉花品种叶片的可溶性糖含量逐渐升高(图2-C)。耐盐品种中9806和盐敏感品种中S9612在S1处理中叶片可溶性糖含量均与CK无显著差异(P> 0.05), S2和S3处理中其叶片可溶性糖含量均较CK显著(P< 0.05)增加, S3处理中耐盐棉花品种叶片可溶性糖含量较CK增幅大于盐敏感品种中S9612。
由图3可知, 随着NaCl浓度的升高, 耐盐棉花品种中9806和盐敏感品中S9612的抗氧化酶活性均呈现先上升后下降的趋势。耐盐品种中9806叶片中超氧化物歧化酶(SOD)活性在S1、S2、S3处理中均显著高于CK(P< 0.05), 分别是CK的1.41倍、1.58倍和1.28倍(图3-A)。盐敏感品种中S9612叶片的SOD活性在S1和S3处理中与CK无显著差异, 在S2处理中显著高于CK。
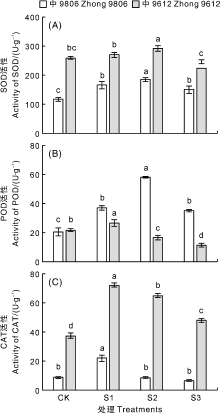 | 图3 盐胁迫对棉花幼苗叶片抗氧化酶活性的影响Fig.3 Effects of salt stress on antioxidant enzyme activity of cotton seedling leaves |
在各浓度盐处理下, 耐盐品种中9806叶片的过氧化物酶(POD)活性均显著高于CK(P< 0.05), 分别是CK的1.81倍、2.83倍和1.71倍(图3-B)。盐敏感品种中S9612在S1处理中叶片POD活性较CK显著(P< 0.05)增加, 是CK的1.23倍, 但在S2和S3处理中POD活性显著低于CK(P< 0.05), 分别较CK降低了23.29%和47.78%。各盐处理中耐盐品种中9806叶片POD含量均高于盐敏感品种中S9612。
耐盐品种中9806在S1处理中叶片中过氧化氢酶(CAT)活性较CK显著(P< 0.05)增加, 在S2和S3处理中其叶片CAT活性与CK无显著差异(P> 0.05), 较CK分别降低了3.43%和26.08%(图3-C)。各盐处理中盐敏感品种中S9612的叶片CAT活性均显著高于CK(P< 0.05), S1、S2和S3处理中叶片CAT活性分别是CK的1.93倍、1.74倍和1.29倍。
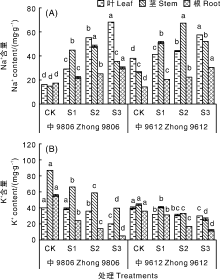
由图4-A可知, 耐盐品种和盐敏感品种的叶和根中Na+含量均随着NaCl浓度的增加显著升高(P< 0.05)。S3处理中, 中9806和中S9612的叶片Na+含量均显著(P< 0.05)高于其他处理; 耐盐品种中9806在S1、S2、S3处理叶片Na+含量分别是CK的1.81倍、3.44倍和4.25倍, 根中Na+含量分别是CK的1.29倍、1.47倍和1.76倍。2个棉花品种茎的Na+含量随NaCl浓度的升高均呈现先升高后降低的趋势, 但各处理Na+含量仍显著高于CK, 中9806和中S9612均在S2处理中Na+含量最高。
随着NaCl浓度的增加, 耐盐棉花品种和盐敏感棉花品种叶片、茎和根中的K+含量随之下降(图4-B)。其中, 耐盐品种中9806叶片K+含量在S1处理中与CK无显著差异(P> 0.05), 在S2、S3处理中较CK均显著(P< 0.05)降低, S1、S2和S3处理分别较CK降低2.50%、10.00%、50.00%。盐敏感品种中S9612茎和根中的K+含量在各盐处理下较CK均显著降低(P< 0.05), 但其叶片K+含量在S1、S2处理和S2、S3处理下差异不显著(P> 0.05), S1处理显著(P< 0.05)高于S3处理。
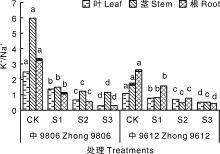
随着NaCl浓度的升高, 耐盐品种中9806叶片、茎和根的K+/Na+均显著降低(P< 0.05), 盐敏感品种中S9612叶片、茎和根的K+/Na+也随着NaCl浓度的升高而降低, 在S2和S3处理中, 其茎中K+/Na+无显著性差异(P> 0.05)(图5)。总体来看, 耐盐品种茎中的K+/Na+略微高于盐敏感品种。尽管随着盐浓度的升高植株K+/Na+逐渐下降, 但是耐盐品种中9806叶片的K+/Na+逐渐高于根部的K+/Na+, 而盐敏感品种中S9612叶片的K+/Na+在S1、S2处理中低于根部的K+/Na+, 在S3处理中高于根部的K+/Na+。
本研究表明, 随着NaCl浓度的增加, 棉花植株MDA含量逐渐增加, 但耐盐品种(中9806)叶片MDA积累量在高盐浓度下低于盐敏感棉花品种(中S9612)。丙二醛是膜脂过氧化产物之一, 破坏了生物膜的结构与功能, 其含量水平代表膜受损害程度[20]。高盐胁迫下活性氧的增加导致细胞膜脂质过氧化, 进而导致细胞内产生大量的丙二醛, 而耐盐品种能够通过降低脂质过氧化反应来提高自身耐盐性[21]。本研究中各棉花品种可溶性蛋白、脯氨酸、可溶性糖含量较CK均有增加, 表明盐胁迫下棉花通过合成渗透调节物质启动自我保护机制[22]。研究发现, 可溶性蛋白是评价植物耐盐性的重要指标之一, 盐胁迫下可溶性蛋白含量越高表明其代谢能力越强[23]。本研究中耐盐棉花品种在盐处理下叶片可溶性蛋白积累量高于盐敏感棉花品种, 推测这是耐盐棉花对盐胁迫的适应能力之一。脯氨酸是植物中重要的有机小分子渗透调节物质, 研究发现, NaCl胁迫下脯氨酸含量显著提高[24]。本研究发现, 耐盐品种和盐敏感品种脯氨酸含量有所差异, 但总体上随盐浓度的增加呈升高趋势, 且耐盐品种在高盐浓度下叶片脯氨酸积累量高于盐敏感品种。可溶性糖做为有机渗透调节物质之一, 能够对细胞膜起到保护作用[25]。本研究中盐胁迫下棉花可溶性糖含量显著增加, 且随着NaCl浓度的增加, 耐盐品种和盐敏感品种在各盐处理下其叶片可溶性糖积累量差异不明显, 这可能是因为其中一部分可溶性糖作为有机渗透调节物质降低渗透势而缓解渗透胁迫, 另一部分清除活性氧维持细胞稳定结构[26]。
植物在逆境胁迫下产生的超氧阴离子自由基(
本研究中耐盐品种Na+的积累量与盐敏感品种存在差异。王旭明等[32]研究发现, 耐盐品种Na+积累量多; 王仁雷等[33]研究表明, 耐盐品种体内Na+含量积累较少, 这可能与棉花基因型有关系。维持细胞内K+稳态是维持植株体内蛋白质合成、离子平衡、胞质pH稳定的关键[34]。本研究中, 盐胁迫显著降低了棉花体内的K+含量, 且叶片中K+含量降低幅度低于根系, 这表明盐胁迫下会造成植株K+大量流失, 植株对K+有较强的转运能力, 能够减缓K+含量的流失, 从而保证地上部分低Na+高K+的环境, 维持自身离子平衡[35]。本研究中耐盐品种叶片的K+含量高于盐敏感品种, 推测耐盐品种能够缓解其K+流失从而降低盐胁迫对植株的毒害。耐盐品种叶片的K+/Na+整体上高于盐敏感品种, 且随着NaCl浓度的升高, 耐盐品种叶片的K+/Na+逐渐高于根系, 而盐敏感品种仅在S3处理中叶片K+/Na+高于根部, 这表明棉花在高盐环境下会进一步维持体内K+吸收能力从而使其适应盐胁迫环境[36], 而盐胁迫下有效地调节Na+和K+的运移并保持K+/Na+平衡是植株的耐盐能力之一[37, 38]。
综上可知, 耐盐棉花品种能够维持较低的MDA含量和较高的渗透调节物质含量来适应盐胁迫环境, 棉花POD、SOD与CAT活性随NaCl浓度升高呈先上升后降低的趋势, 且耐盐品种SOD和POD活性积累量较盐敏感品种大; 盐胁迫下, 耐盐棉花品种的K+/Na+比盐敏感品种高, 并且能保持叶片K+/Na+高于根系, 从而增强幼苗的耐盐能力。
(责任编辑 侯春晓)
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|