作者简介:邱文怡(1995—),女,江西吉安人,硕士研究生,主要从事植物抗逆性和稻米品质研究。E-mail:757441862@qq.com
基因的时空表达受转录因子的精确调控。植物在面对不利环境因素比如高温、低温、干旱、盐碱等胁迫时其细胞生理生化会迅速地从“舒适”状态转变进入“胁迫响应”状态。这种快速响应的状态转变依赖于植物对胁迫信号的感知及传递、激素通路(脱落酸、茉莉酸等)的激发、转录因子的活化等复杂的过程;最终植物通过胁迫相关基因的表达、次生代谢转变、抗氧化物质的积累等实现胁迫条件下细胞内环境的再平衡从而获得生存。植物MYB(v-MYB avian myeloblastosis viral oncogene homolog)转录因子就是上述转变中的重要参与者。本文介绍了植物MYB转录因子的结构特征、分类,综述了近些年来MYB转录因子与非生物胁迫,以及植物激素应答过程相关的研究进展。
The expression of a gene is tightly controlled by transcription factors in a spatiotemporal way. When facing adverse environmental conditions such as heat, cold, drought or salt stress, plant cells conduct a physiological change from “fitness” to “stress response” immediately. This fast response relies on complex strategies including the perception and transduction of the stress signal, initiating hormone signaling (abscisic acid, jasmonic acid etc.), transcription factor activation etc. These processes turn out the expression of stress related genes, secondary metabolic transformation, antioxidants accumulation etc. All these efforts confer plants to strive a rebalance of cell homeostasis under stress, and so enable plants to survive. Plant MYB (v-MYB avian myeloblastosis viral oncogene homolog) transcription factors are important participants in these procedures. This manuscript described the plant MYB transcription factor's structure features, classification, and mainly focused on the recent advances in the researches about MYB’s functions in response to abiotic stress and plant hormones.
MYB转录因子是植物体内最大的一类转录因子之一, MYB基因家族在植物众多的生理过程, 比如细胞周期、环境应答、胁迫响应以及初生代谢、次生代谢等方面都起着重要的作用。随着拟南芥、水稻等多种植物的全基因组测序完成, 实验技术及手段的进步, 使得科研人员可以对MYB基因家族在内的基因资源进行更为广泛和深入的研究, 这些研究结果不仅可为改良作物遗传及抗逆提供理论依据及支持, 也可以直接作为基因资源加以利用。
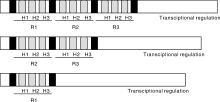
MYB转录因子家族是一类含有高度保守的DNA结合域, 即MYB结构域的转录因子。MYB结构域是由50~52个氨基酸为一个重复组成的高度保守的肽段, 每个MYB转录因子含有1~4个重复的MYB结构域。每个MYB重复含有3个α -螺旋(α -helix), 在第2、3个螺旋之间由1个转角(turn)相连(图1), 形成一个稳定的H-T-H三维结构。在MYB结构域序列中每18~19个氨基酸残基之间都有一个色氨酸残基(W), 其主要的作用是在H-T-H三维结构中形成一个疏水核心[1]。第一个被鉴定的MYB基因是禽成髓细胞瘤病毒(AMV)的v-myb癌基因, 由Klempnauer在1982年克隆的, 之后在正常细胞中也发现了相应的原癌基因c-myb。研究表明, V-MYB蛋白和C-MYB蛋白的DNA结合功能区都具有MYB结构域, 至此一类新的基因, 具有MYB结构域的转录因子家族得以形成[2, 3]。MYB转录因子家族(TF)都具有一个保守的MYB结构域, 存在于所有的真核生物中。1987年从玉米中克隆到了第一个植物MYB类转录因子— — ZmMYBC1, 研究发现ZmMYBC1主要参与花青素的合成, 在此之后在植物中发现和分离了大量的MYB类转录因子[4], 使之成为植物中数量最多的一类转录因子之一。
MYB转录因子分类中, 以c-Myb转录因子所含的3个重复R1、R2、R3为重复原型, 其他的MYB转录因子根据所含MYB重复的数量, 及与原型重复的相似性分为4个亚类(图2), 分别为4R-MYB、R1R2R3-MYB、R2R3-MYB和1R-MYB[5]。1R-MYB亚组只包含一个R结构域, 称为1R-MYB/MYB-related。这些MYB蛋白是重要的端粒结合蛋白, 在维持染色体结构完整性和调控基因转录方面发挥着重要作用[6], 对于细胞和组织形态发生、周期节律具有重要的生物学意义。MYB转录因子的亚类R2R3-MYB是MYB转录因子家族中数量最多的一个亚类, 拟南芥中大约有120多个, 水稻中也有90多个。它们都包含两个R结构在蛋白的N-末端— — R2R3, 通常蛋白的C端有着转录激活功能, 它们广泛参与细胞分化、激素响应、次生代谢、环境胁迫和抗虫抗病等过程[7]。含有3个R结构域的MYB转录因子亚类R1R2R3-MYB在植物中含量相对较少, 已知高等植物拟南芥、水稻、烟草的基因组仅编码5个3R-MYB基因。它们的功能主要是参与细胞周期和细胞分化, 也与植物对逆境的耐受性密切相关。第四个亚类4R-MYB的数量最少, 只在拟南芥、葡萄和杨树中有发现有单个的4R-MYB, 它们的功能也知之甚少[8]。
植物在面对非生物胁迫比如干旱、高温、冷害、重金属、盐等不利环境因素时, 为了生存植物会从转录水平到代谢水平做出快速的响应, 即诱导表达胁迫响应基因、抗氧化物基因等逆境相关基因的表达来改变其代谢过程从而维持胁迫条件下细胞的内稳态。胁迫响应导致的转录重编程受转录因子的直接调控, 同时又伴随着各种植物激素通路的放大或反馈调节等过程。植物MYB类转录因子广泛地参与植物对非生物胁迫的响应, 它们直接参与调控相应胁迫响基因的表达, 调控次生代谢, 或间接地通过植物激素的调节参与胁迫响应及抗性形成过程[9]。下面将近些年在植物领域MYB转录因子参与非生物胁迫及植物激素响应(表1)方面的研究结果进行简要概述。
| 表1 已知与植物非生物胁迫及植物激素响应相关的MYB转录因子及功能 Table 1 MYB transcription factors and functions related to plant abiotic stress and plant hormone response |
非生物胁迫中干旱是最主要的一种, 它会对植物的营养生长和生殖发育产生许多不利的影响, 严重危害作物的品质和产量。MYB类转录因子通过多种途径参与植物对干旱胁迫的响应。SbMYB15(Salicornia brachiata Roxb)在烟草中过表达能显著增强其对盐及PEG模拟的干旱胁迫的抗性。生化实验表明, 在胁迫条件下, 转基因烟草的叶绿素含量、可溶性糖含量、脯氨酸及总氨基酸含量均高于野生型, 此外细胞膜的稳定性也更好[10]。鞑靼荞麦(Fagopyrum tataricum)是一种抗性很强的作物, 对各种胁迫均表现出较强的抗性。在拟南芥中过表达R2R3-MYB转录因子AtMYB44、FtMYB9、FtMYB13均能增强转基因植株对盐和干旱胁迫的抗性, 其中过表达FtMYB9、FtMYB13的转基因植株与对照相比, 这些转基因植株积累了更多的脯氨酸, 一些胁迫响应基因的表达更高, 从而维持体内较低的活性氧(ROS)及丙二醛(MDA)积累[11, 12, 13]。棉花(Gossypium arboreum)的R2R3-MYB转录因子GaMYB85也具有相似的功能, 在拟南芥中过表达GaMYB85能促进转基因植株的自由脯氨酸及叶绿素的积累, 提高胁迫响应基因RD22、ADH1、RD29A、P5CS及ABI5的表达从而增强植株对干旱及盐胁迫的抗性[14]。毛果杨(Populus trichocarpa)R2R3类MYB转录因子PtrMYB94表达受脱水胁迫诱导, 与野生型植株比较, PtrMYB94过表达植株抗旱能力增强, 进一步分析表明, 过表达植株脱落酸(ABA)含量增加, 同时ABA及干旱响应基因的表达也出现升高, 表明PtrMYB94能通过增强ABA途径增强植株的抗旱能力[15]。大麦HvMYB1也正向调控植物的抗旱能力, 生理实验表明, 在干旱胁迫下过表达HvMYB1的转基因大麦抗旱能力更强, 与野生型比较, 转基因植株的相对含水量高, 气孔导气度低, 失水速率小; 得益于更高的HvDNH6表达水平, 细胞内渗透调节物质脯氨酸含量更高, 抗氧化物含量也较野生型高, 所以胁迫条件下产生的活性氧自由基就少, 综合以上特性, 转基因植株的耐旱能力得到增强[16]。过表达小麦(Triticum aestivum L.cv. Chinese Spring)TaGAPCp2/3(位于非绿色质体的甘油醛3磷酸脱氢酶)能提高小麦的抗旱能力, 而TaMYB能直接结合TaGAPCp2/3启动子的MYB结合位点, 促进这两个基因的表达, 最终提高小麦的耐旱能力[17]。Guo等[18]通过蛋白-染色质免疫共沉淀发现桦树(Betula platyphylla)BplMYB46能直接结合苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、超氧化物歧化酶(SOD)等胁迫响应、抗氧化基因的启动子上的MYB-cis元件, 并促进这些基因的表达, 从而提高植物的非生物逆境的抗性。类似的现象也在对TaP1MP1的研究中发现, 过表达TaP1MP1的烟草植株在干旱条件下表现出很强的耐受性, 理化试验表明, 转基因植株中SOD、PAL活性显著较野生型高[19]。
MYB类转录因子负调控植物对干旱胁迫响应的研究也有报道。例如, FtMYB10自身表达受ABA及干旱胁迫诱导, 过表达FtMYB10的拟南芥种子萌发时对ABA敏感度降低, 植株对盐及干旱的抗性减弱, 实验表明, 转基因植株脯氨酸积累减少, 脯氨酸合成相关基因P5CS1表达下降; 另外胁迫响应基因DREB1、RD29B、RD22以及一些DRE/CRT家族的基因表达较野生型显著下调[20]。
综上所述, MYB类转录因子参与调控植物干旱耐性形成的机制大多包括增加胞内自由脯氨酸的积累, 提高过SOD、过氧化氢酶(CAT)、PAL等抗氧化氢酶的含量与活性, 增加胁迫响应基因的表达等。通过这些措施维持细胞内较低的ROS、MDA等有害次生代谢产物的积累, 维持细胞膜的稳定性, 最终获得更好的抗干旱能力(图3)。
MYB转录因子也参与植物对高温胁迫的响应。通过对高温胁迫下植物转录组的分析表明, 许多MYB转录因子参与了高温胁迫的应答。Zhang等[21]在水稻幼穗基因表达谱分析中发现, 9个(R1)R2R3、7个MYB-related和3个非典型MYB 转录因子对高温有反应。Liu等[22]研究表明, 葡萄叶片受热激后一些MYB转录因子表达出现了变化, 表明它们参与了高温胁迫反应。拟南芥R2R3类MYB转录因子AtMYB68基因只在根的柱状鞘细胞中特异表达。高温胁迫下, 植物根中的MYB68::GUS的活性大幅度增加, 表明AtMYB68的表达受高温诱导, 突变体myb68与野生型相比生长受阻, 表明MYB68可能参与了拟南芥高温胁迫下营养生长的某一过程[23]。
低温冷害或冻害都会对植物造成严重的危害。植物在进化过程中形成了以CBF途径为主其他多种途径为辅的抵御低温冷害胁迫的响应机制(图3)。到目前为止, 研究发现了不少MYB转录因子参与植物对低温胁迫的响应[24, 25]。在拟南芥或苹果愈伤中过表达MdMYB73能显著增强转基因植株和愈伤的冷胁迫抗性, 转录表达分析表明转基因愈伤中冷响应基因MdCBF2、MdCBF3、MdCBF4和MdCBF5的表达显著上升, 表明MdMYB73增强植物抗冷胁迫能力是依赖CBF途径[24]。MdMYB23也能直接促进MdCBFs的表达从而提高转基因苹果愈伤及拟南芥的冷胁迫能力[26]。MYB转录因子也会辅助其他转录因子诱导冷胁迫基因的表达从而增强植物的耐冷胁迫的能力。苹果(Malus domestica)bHLH转录因子MdbHLH33直接促进MdCBF2、MdDFR的转录提高苹果愈伤花青素积累及耐冷胁迫的能力; 蛋白实验表明, MdMYB308L能与MdbHLH33相互作用, 并增强后者与MdCBF2和MdDFR启动子结合的能力从而增强苹果愈伤的冷胁迫抗性[27]。MYB也广泛地通过其他途径参与植物的耐冷胁迫。水稻OsMYB3R-2表达受冷胁迫诱导, 过表达OsMYB3R-2的拟南芥植株在-8 ℃处理10 h后, 常温恢复6 d, 植株存活率为84.5%, 而同一条件处理下的野生型植株存活率仅为26.8%, 表明OsMYB3R-2能显著增强转基因拟南芥的抗冷能力[28]。基因表达分析表明, OsMYB3R-2能诱导多个冷胁迫相关基因(DREB2A、COR15a、RCI2A)的表达。后续研究表明, OsMYB3R-2在水稻中过表达也能显著地提高水稻植株的耐冷能力; 分子生物学实验表明, 低温条件下, OsMYB3R-2促进OsCycB1; 1的表达, 增强转基因植株的细胞有丝分裂, 进而提高转基因植株的抗冷能力[29]。香蕉(Musa acuminat)MaMYB4能提高香蕉果实的低温存储品质。亚麻油酸(linoeic acid, LA; C18:2)以及α -亚麻油酸(α -linolenic acid, ALA; C18:3)是两个重要的不饱和脂肪酸, 对维持细胞膜的完整性具有不可替代的作用, ω -3脂肪脱氢酶(FADs)催化LA转变为ALA。低温存储条件下, 香蕉果实中3个ω -3 FADs(MaFAD)的启动子中组氨酸H3、H4的乙酰化程度增加, 基因表达被诱导, 使得果实中LA、ALA含量及ALA/LA值较常温存储要高, 膜的导电率增加, 果实出现冷害损伤。ChIP-qPCR表明, MaMYB4能直接与3个ω -3 FADs启动子的MYB结合位点结合并且抑制三者的转录从而提高香蕉果实低温存储品质。蛋白实验表明, 该抑制作用是MaMYB4通过与组氨酸去乙酰化酶(MaHDA2)相互作用, 从而降低ω -3 FADs启动子的组氨酸乙酰化程度来实现的[30]。百合(Lilium lancifolium)LiMYB3表达受低温诱导(4 ℃), 在拟南芥中过表达LiMYB3植株表现出耐冷胁迫特性, LiMYB3与花青素合成相关基因存在很高的共表达特性, 酵母单杂交实验表明, LiMYB3能结合LiCHS2(查尔酮合酶)花青素合成路径中的一个关键酶启动子中的MYB结合位点, 促进其转录[31]。玉米是喜温作物, 当环境温度低于12 ℃时, 玉米就会出现低温伤害, ZmMYB31表达受低温诱导, 在拟南芥中过表达ZmMYB31能增强植株的耐冷胁迫, 生化实验表明, 转基因拟南芥在低温下光合效率下降少, 抗氧化物质积累多, 冷胁迫响应基因的表达更高[32]。
另外也有间接的证据表明, MYB参与了植物茉莉酸(JA)介导的耐冷胁迫。茉莉酸是植物CBF/DREB1冷胁迫响应途径的早期关键信号。Mao等[33]通过籼粳交(籼稻Teqing, 粳稻02428)分离克隆了一个与耐冷相关的主效QTL位点HAN1, 该基因编码茉莉酸氨基酸氧化酶, 将活性JA-Ile氧化成非活性12OH-JA-Ile, 负调控茉莉酸信号。HAN1受冷胁迫诱导, 并且负调控植物耐冷胁迫。测序发现该基因的编码区在两亲本之间没有差异, 但是在启动子中的MYB结合位点存在一个SNP差异。实验表明, 该位点为A的HAN1启动子驱动的荧光素酶、GUS基因的表达水平均高于该位点为G的HAN1启动子; 冷胁迫处理也表明前者在低温处理下表达水平更高, 利用CRISPR/Cas9敲除该MYB位点后, 转基因水稻变得低温敏感。综上所述, HAN1可能在茉莉酸调控的植物耐冷胁迫中起到负反馈调节的作用, 防止冷胁迫下积累过多的茉莉酸而带来副作用, 并且该基因的表达受到未知的MYB转录因子的调控。
MYB转录因子负调控植物高温, 低温胁迫抗性的报道也不鲜见。拟南芥AtMYB15也负调控转基因植株的冷抗性, 过表达AtMYB15能抑制CBFs的表达, 从而降低转基因植株的抗性[25]。水稻OsMYB55功能丧失突变体pl花青素合成基因表达上调, 花青素积累增多, 突变体种子萌发时耐高温能力较野生型强[34]。水稻OsMYB30与OsJAZ9互作, 在负调控水稻的冷胁迫响应, OsMYB30能直接结合β -淀粉酶(BMY2、BMY6、BMY10)的启动子并抑制这些基因的表达, 从而降低水稻冷胁迫下淀粉合成, 以及麦芽糖(作者推测具有保护细胞膜的作用)等的积累, 导致植株对冷敏感[35]。苹果MdMYB15L就是一个典型冷胁迫负调控因子。在果肉愈伤中过表达MdMYB15L能显著抑制MdCBF2的表达, 降低愈伤冷胁迫抗性[36]。
高盐是植物面对的另一主要非生物胁迫, 植物可以通过一系列调节机制应对外界高盐胁迫环境, 包括提高细胞抗氧化能力, 通过积累渗透调节物质提高渗透压, 改变次生代谢增强膜稳定性, 主动向细胞外排出Na+等(图3)。番茄(Solanum lycopersicum L.)R2R3类MYB转录因子SlMYB102其表达受盐胁迫诱导。在番茄中过表达SlMYB102虽然会导致植株矮化, 但是却增强了植株对持久盐胁迫(125 mmol· L-1 NaCl处理25 d)的抗性。生化实验表明, SlMYB102过表达植株对盐胁迫的抗性可能来自于其能维持一个较低的Na+/K+值, 较低的活性氧自由基、MDA等, 同时在盐胁迫条件下的转基因番茄叶片细胞内抗氧化酶(SOD、POD、CAT、APX)的活性也更高[37]。拟南芥MYB111正向调控植株的耐盐胁迫能力, AtMYB111的过表达植株比野生型表现出更强的耐盐特性, 而AtMYB111的基因敲除植株则对盐胁迫比野生型敏感。分子实验表明, AtMYB111表达受盐胁迫诱导, 参与植物体内黄铜类物质的合成, 其能直接结合F3H(Flavanone carboxylase)、FLS1(flavonol synthase 1)、CHS(chalcone synthase)这些黄酮类合成基因的启动子促进这些基因的转录, 从而增强植株的耐盐能力[38]。在棉花(Gossypium hirsutum)中下调GhMYB73的表达导致棉花对盐胁迫敏感, 在盐胁迫条件下, GhMYB73的过表达能增强渗透胁迫响应基因的表达从而提高转基因植物的耐盐能力[39]。过量表达大豆(Glycine max L.)R2R3-MYB转录因子GmMYB68使得转基因大豆比野生型更耐盐胁迫, 在盐胁迫条件下, 转基因大豆种子数, 及百粒重均较野生型高[40]。农艺性状改良主要得益于转基因植株更高的光合速率, 细胞内积累了更多的可溶性糖、脯氨酸等渗透调节物质。
此外, 不少研究表明MYB转录因子还参与植物对重金属离子的胁迫。萝卜(Raphanus sativus)RsMYB1主要调控花青素合成, 在烟草和矮牵牛中过表达RsMYB1能显著增强花青素合成。过表达该基因的转基因矮牵牛还表现出了对锌、铜、铬等重金属离子的抗性, 生化实验表明, RsMYB1的过表达能促进矮牵牛与重金属解毒相关的基因的表达, 比如谷胱甘肽基因(GST)、络合素酶基因(PCS)以及抗氧化物酶基因例如SOD、CAT、过氧化物酶(POX)的表达, 从而增强转基因植株对胁迫的抗性[41]。SbMYB15(Salicornia brachiata Roxb)表达受重金属离子镉和镍的诱导, 在烟草中过表达SbMYB15能显著增强转基因烟草的抗重金属胁迫的能力, 生理生化分析表明, 转基因植株在重金属胁迫下积累的重金属离子的量及产生的ROS较野生型少, 同时植株体内CAT、SOD等抗氧化物酶的活性更强, 最终赋予SbMYB15过表达烟草更强的抗重金属胁迫的能力[42]。MYB转录因子负调控植物镉胁迫也有报道, 拟南芥AtMYB49能直接结合AtbHLH38和AtbHLH101的启动子并驱动他们的表达, 后两者能促进一个参与镉吸收的金属运输基因(IRON-REGULATED TRANSPORTER 1)的表达, 同时AtMYB49还能直接上调重金属关联异戊二烯化植物蛋白(heavy metal-associated isoprenylated plant protein)HIPP22、HIPP44的表达, 它们共同促进了植物对镉的吸收和积累。在镉胁迫下, 过表达AtMYB49的转基因植株积累更多的镉, 生长受阻, 而AtMYB49敲除植株则由于镉吸收积累减少而对镉处理敏感度较野生型弱。该途径受ABA调控, AtABI5能直接与AtMYB49相互作用从而抑制其与AtbHLH38及AtbHLH101的启动子结合从而抑制植物对镉的吸收[43]。AtMYB59具有调控钙离子内稳态的功能, 其能促进包括钙结合蛋白, 钙转运蛋白以及钙信号传递基因在内的基因的表达, 由于镉也能被钙转运蛋白吸收进入胞内, 因此, AtMYB59过表达植株对镉处理敏感, 而其突变体myb59则表现出对镉更强的耐性[44]。
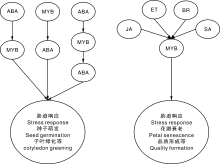
植物激素是植物体内调节各种生理生化反应从而使生命活动得以正常进行必不可少的物质。植物中有些MYB基因的表达与植物激素密切相关。Sun等[45]对19个马铃薯MYB转录因子对ABA、GA3、IAA的响应进行了研究, 结果表明, StMYB60等5个基因的表达受ABA诱导, 而StMYB12等6个转录因子受GA3诱导, 只有StMYB89表达受IAA诱导, 另外StMYB127及StMYB141对3个激素都没有响应, 众多的MYB基因对激素不同的响应方式也预示了他们不同的功能特性。目前的研究中ABA对MYB基因表达的影响研究的较为深入。主要划分以下3种类型:ABA依赖型、诱导型和介导型(图4)。AtMYB52、AtMYB70、AtMYB73和AtMYB52可以通过ABA依赖途径来参与胁迫中的应激反应[46]。参与ABA诱导型的基因有小麦的TaMYB1、TaMYB2、TaMYB3R1[47, 48]。另外在拟南芥中AtMYB2和AtMYB41可以促进ABA的大量积累来参与植物受到的逆境胁迫反应[49, 50]。棉花(Gossypium hirsutum)转录因子GhMYB73表达受ABA诱导, 过表达GhMYB73的拟南芥植株种子萌发、子叶绿化速度对ABA不敏感, 盐胁迫下ABA响应基因的表达水平也比野生型高, 进一步的蛋白互作实验表明, GhMYB73与拟南芥ABA受体蛋白AtPYL8及其在大麦中的同源基因GhPYL8互作, 表明GhMYB73参与了ABA途径[39]。ABA抑制种子萌发, 过表达水稻R1R2R3类MYB转录因子OsMYB3R-2的转基因拟南芥种子萌发对ABA不敏感, 0.5 μ mol· L-1 ABA能显著抑制拟南芥种子萌发(萌发率为30%), 而前者萌发率高达80%[28]。核桃(Juglans regia)转录因子JrMYB2表达受ABA诱导, 其能直接结合JrVHAG1(G-subunit of vacuolar H+-ATPase)启动子的MYB核心cis元件, 后者的表达能增强拟南芥对镉胁迫的抗性[51]。FtMYB9和FtMYB13均正向调控植株的耐干旱胁迫抗性, 然而它们的转基因植株对ABA处理表现出相反的表型。过表达FtMYB9的转基因植株在萌发及苗期对ABA敏感, 而FtMYB13的转基因拟南芥却对ABA不敏感, 表明两者可能都参与了植物对ABA信号响应的调控[11, 12], 转基因植株对ABA的响应差异可能是两者自身不同的转录活性造成的, FtMYB9具有转录激活功能, 而FtMYB13则不具有转录激活功能。拟南芥RSM1能直接结合ABI5的启动子并调控其表达, 从而调控ABI5下游及胁迫响应基因的表达, 从而增强转基因植物的耐逆性[52]。拟南芥R-R MYB转录因子AtDIV2表达受盐胁迫及ABA诱导, 其功能丧失突变体div2耐盐胁迫抗性显著增强, ABA含量增加, ABA相关基因ABA1及ABI3的表达增加, 这些结果表明AtDIV2参与了ABA信号传递并且负调控植物的耐盐胁迫[53]。MYB基因参与其他激素响应的报道也非常丰富(图4)。蔷薇(Rosa hybrida)R2R3-MYB基因RhMYB108参与了乙烯和茉莉酸诱导的花瓣衰老过程, 茉莉酸乙烯诱导RhMYB108表达, 后者直接结合RhNAC053、RhNAC092、RhSAG113的启动子并促进他们的表达, 花瓣开启衰老过程[52]。拟南芥AtMYB59在叶片中的表达受水杨酸(SA)诱导[54], 同时也表现出一个对茉莉酸处理的早期响应[53], 而AtMYB49则受茉莉酸抑制[55]。水稻R2R3-MYB转录因子OsCSA表达受油菜素内酯(BR)调控, BR促进OsBZR1的表达, OsBZR1直接促进OsCSA的转录, 后者直接调控与淀粉合成相关基因AGPL2、SSIIa和ISA2的表达参与养分运输分配及种子发育[56]。水杨酸处理能诱导瞿麦(Dianthus superbus L.)MYB表达, 并增强植株对低浓度盐(NaCl)胁迫的抗性[57]。综上所述, MYB类转录因子与植物激素的应答途径紧密相关。
植物MYB类转录因子是最大的转录因子家族之一。MYB转录因子广泛参与植物生长发育、胁迫响应、激素信号传递与调控等重要的生理生化过程, 也是植物转录因子研究中的热点。未来对MYB转录因子研究将主要着重于几点:第一, MYB参与调控的非生物逆境例如干旱、低温、盐害等已经获得了不少的结果和基因资源, 但是有些基因在增强耐逆能力的同时, 对生长发育却有不利影响, 无法直接利用。因此, 未来还要继续大力地发掘这方面的基因资源, 以及开发新的利用方式, 比如采用组织特异性表达, 或诱导表达等方式降低组成型表达对受体植株生长的影响; 第二, 当前已有研究表明MYB转录因子在水稻中参与籽粒的品质形成, MYB参与调控稻米品质形成的机制, 比如对口感影响较大的直链淀粉的含量的影响, 是否能改善水稻高温逆境下的外观品质即抑制垩白的形成, 以及与植物激素之间的关系仍有待进一步研究; 第三, 当前MYB转录因子与ABA的关系研究较为详细, 但是与其他重要植物激素的研究则相对较少, 特别是对MYB与茉莉酸和水杨酸这两种与植物衰老、抗性相关的激素互作研究亟需深入。在将来的研究中, 进一步探索MYB参与上述过程的途径、方式、调控机制可以为精准改良作物耐逆性状提供更为详细的理论指导依据。
(责任编辑 张 韵)
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|