作者简介:武秋颖(1985—),女,河北唐山人,硕士,实验师,研究方向为生物化学与微生物学。E-mail:wuqiuying123@126.com
为了培育出具有优良互补性状的平菇和杏鲍菇新菌株,以高产、抗杂能力强的平菇品种CCEF89和优质、适应性强的杏鲍菇品种PL7为亲本菌株,建立原生质体聚乙二醇(PEG)融合体系,得到最佳融合条件:两亲本原生质体数量按1:1混合,30% PEG 6000,0.01 mol·L-1Ca2+,32 ℃水浴30 min,融合率达0.010 1%~0.028 2%。通过拮抗反应试验和Rep-PCR分子鉴定,从515个融合再生菌株中获得12个融合菌株P1~P12;出菇试验表明,P1和P5为杏鲍菇新菌株,其他为平菇新菌株。P1和P5的产量、生物学效率均显著高于其亲本菌株PL7,并且抗杂能力显著提高;与亲本菌株CCEF89相比,平菇新菌株P4、P10和P11长满培养料和形成原基的时间缩短5.5~7.3 d,第1茬平均产量提高18.0%~24.0%,总生物学效率提高21.00%~27.67%。利用原生质体融合技术培育出了具有亲本优良互补性状的平菇和杏鲍菇新菌株,为同时进行2种不同食用菌的种质资源创新和新品种选育提供了一种新途径。
In order to breed new strains combining the elite complementary traits of Pleurotus ostreatus and Pleurotus eryngii, Pleurotus ostreatus variety CCEF89 with the properties of high yield and strong ability to resist contamination, and Pleurotus eryngii variety PL7 with the properties of high quality and strong adaptability were used as the parent strains to build the PEG (polyethylene glycol)protoplast fusion system.Under the optimal protoplast fusion condition of 1:1 quantity ratio of the parent strains, 32 ℃ water bath, 30% PEG 6000, 0.01 mol·L-1 Ca2+ and 30 min co-incubation, the fusion rate was up to 0.010 1%-0.028 2%. 12 protoplast fusants (P1-P12) were identified by antagonistic reaction test and Rep-PCR molecular identification from 515 protoplast fusion regeneration isolates. After the mushroom cultivation experiments, P1 and P5 were identified as new strains of P. eryngii, and the other 10 protoplast fusants were new strains of P. ostreatus. The mushroom yield and biological efficiency of new strains P1 and P5 were significantly higher than those of their parent PL7, and their ability to resist contamination were increased significantly. Comparing to the parent CCEF89, the time of medium cultivation and mushroom primordia formation of P. ostreatus new strains P4, P10 and P11 were 5.5-7.3 days earlier, the yield of the first harvest mushroom and the total biological efficiency increased by 18.0%-24.0% and 21.00%-27.67%, respectively.Using the protoplast fusion technology, we acquired P. ostreatus and P. eryngii new strains with excellent complementary properties of the parents simultaneously, and proposed a new pathway to innovate new germplasm resources and bred new varieties of two different edible fungiat the same time.
目前, 人工栽培的食用菌品种大多是通过自然选育、杂交育种、诱变育种等方法培育获得。自然选育受到环境、资源限制, 很难尽快获得目标性状; 杂交育种需要单孢分离和交配型鉴定, 并且筛选优质杂交后代的工作量非常大; 诱变育种的技术操作简单, 但筛选量大且突变性状的遗传稳定性较差[1, 2]。基因工程育种和分子标记育种也有了一定的应用研究, 但食用菌的全基因组测序工作严重滞后, 缺乏对食用菌染色体复制、基因转录、蛋白质翻译及其调控机制的研究, 严重限制了基因工程技术在食用菌育种方面的应用[3]。原生质体融合技术不但能使食用菌保持其优质性状, 而且能够与其他食用菌的优良性状相结合, 可快速表现出新的优良特性; 直接以生产性状为筛选指标, 避免了繁杂的遗传标记:因此, 被广泛应用于金针菇[4]、羊肚菌[5]、猴头菌[6]等食用菌的新品种选育。平菇味道鲜美, 且具有高产和强抗杂菌污染能力的优势[7]; 杏鲍菇有丰富的营养价值和医疗作用[8, 9], 以优质和菌丝强壮、生长旺盛、适应性强为主要特征。本文拟利用原生质体融合技术, 获得具有优良互补性状的平菇和杏鲍菇新菌株, 发挥其潜在的经济价值和药用价值。
平菇CCEF89(CCMSSC00389)来自中国农业科学院农业资源与农业区划研究所国家食用菌标准菌株库。杏鲍菇PL7由河北农业大学园艺学院李明教授馈赠。
取在25 ℃ PDA液体培养基培养5 d的幼嫩菌丝于1.5 mL无菌离心管中, 按照李小六等[10]的方法分别制备平菇CCEF89和杏鲍菇PL7菌株的原生质体。利用血球计数板进行原生质体计数, 利用1%中性红染色进行原生质体死活鉴定, 计算活体原生质体浓度。
用终浓度为0.01 mol· L-1 Ca2+溶液配制的不同质量体积分数(25%、30%、35%和40%)的PEG6000作为促融剂。用0.6 mol· L-1甘露醇(稳渗剂)将平菇CCEF89和杏鲍菇PL7原生质体浓度配制成1× 106 mL-1, 按照1: 1的比例加入1.5 mL无菌离心管中, 加入等体积促融剂, 在32 ℃水浴下进行融合, 显微观察不同水浴时间(10、20、30、40、50 min)的原生质体融合情况。融合率(%)=融合细胞数/亲本细胞数× 100。当观察到90%左右的原生质体出现哑铃型融合细胞时, 978× g离心2 min。用稳渗剂洗去促融剂, 洗2~3次。取0.2 mL融合溶液接种到1 mL蔗糖-蛋白胨培养基(蔗糖20 g, 蛋白胨5 g, 稳渗剂1 000 mL), 25 ℃避光静置培养24 h后, 按每皿0.2 mL涂布到蔗糖-蛋白胨-琼脂培养基(蔗糖20 g, 蛋白胨5 g, 琼脂16 g, 稳渗剂1 000 mL)平板, 25 ℃恒温培养, 观察融合菌株的再生情况。将培养基上产生的单菌落分别转接到PDA培养基中进行培养。在培养过程中, 通过观察菌落形态和菌丝特征, 获得融合后的纯培养菌株。
将融合后的纯培养菌株与2个亲本菌株按照刘海英等[11]的方法进行拮抗反应试验, 筛选出与亲本菌株均具有明显拮抗反应的融合菌株。
按照刘海英等[11]的方法对融合菌株和亲本菌株进行Rep-PCR分子鉴定, 筛选出与亲本菌株具有不同基因型的融合菌株进行出菇试验。
按照刘海英等[11]的方法对融合菌株进行出菇试验, 观测菌丝在培养基的吃料和污染情况, 记录不同菌株开始出现原基的时间和子实体特征, 计算第1茬菇产量和总生物学效率。
按照李小六等[10]的方法制备2个亲本菌株的原生质体, 利用血球计数板进行原生质体计数, 结果发现, 平菇CCEF89和杏鲍菇PL7的原生质体平均浓度分别为4.97× 107 mL-1和3.45× 107 mL-1。利用1%中性红染色检测原生质体活性, 发现平菇CCEF89具有活性的原生质体数占60.1%, 杏鲍菇PL7占77.5%。因此, 平菇CCEF89和杏鲍菇PL7的活体原生质体浓度分别为2.99× 107 mL-1和2.67× 107 mL-1。
2.2.1 PEG浓度对原生质体融合的影响
显微观察原生质体融合时发现, 2个原生质体膜相互接触, 可见到明显的哑铃型融合细胞。在PEG质量体积分数为25%时, 原生质体有破碎现象(图1-A); 当PEG质量体积分数为30%时, 原生质体比较正常(图1-B); PEG质量体积分数高于30%时, 原生质体有缩小现象(图1-C、D)。通过融合率测定, 在融合时间50 min内, PEG质量体积分数为25%时, 出现哑铃型细胞的比例不足0.01%, PEG质量体积分数为30%时, 哑铃型细胞出现的比例最高, 为0.03%, PEG质量体积分数为35%和40%时, 哑铃型细胞出现的比例较低, 为0.01%~0.02%。
 | 图1 PEG浓度对平菇CCEF89和杏鲍菇PL7原生质体融合的影响(10× 40倍)Fig.1 Effects of PEG concentration on the protoplast fusion of P.ostreatus CCEF89 and P. eryngii PL7(10× 40) A, 25% PEG; B, 30% PEG; C, 35% PEG; D, 40% PEG. |
另外, 哑铃型细胞出现的时间也随PEG浓度变化有所不同。当PEG质量体积分数为25%时, 哑铃型细胞出现需40~50 min; 当PEG质量体积分数为30%、35%和40%时, 在10~20 min内就可观察到哑铃型细胞和融合细胞。综合考虑以上试验结果, 在供试的4种PEG浓度中, 30% PEG对原生质体的形态没有显著影响, 哑铃型细胞出现的时间短、比例高, 因此, 平菇CCEF89和杏鲍菇PL7原生质体融合的适宜PEG质量体积分数为30%。
2.2.2 融合时间对原生质体融合的影响
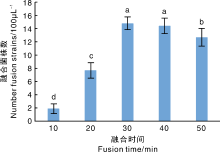
利用30%PEG促融剂, 32 ℃水浴, 将平菇CCEF89和杏鲍菇PL7的原生质体进行融合, 融合时间分别为10、20、30、40、50 min, 显微镜下观察融合情况, 计算每100 μ L融合液再生的融合菌株数量。结果(图2)发现, 0~30 min, 随着融合时间的延长, 融合菌株的数量显著增加, 融合时间为30~40 min时, 融合菌株数量达到最多, 融合时间为50 min时, 融合菌株数量显著下降。考虑到融合时间过长可能会影响融合子再生, 因此, 平菇CCEF89和杏鲍菇PL7原生质体融合的适宜时间为30 min。在最佳融合条件下, 即两亲本原生质体数量按1: 1混合, 30% PEG 6000, 0.01 mol· L-1 Ca2+, 32 ℃水浴30 min, 经过多次重复试验, 融合率达0.010 1%~0.028 2%。
2.3.1 拮抗反应试验
通过原生质体融合, 共获得了515个融合再生菌株。分别将融合菌株与双亲接种于同一PDA平板培养, 结果发现, 菌丝体与亲本菌株菌丝体间有隆起的栅栏状“ 梗” , 说明融合子与亲本间的拮抗作用十分显著(图3)。利用拮抗反应试验, 与两亲本菌株都表现明显拮抗反应的菌株有12个(占融合再生菌株总数的2.3%), 分别命名为P1~P12。
2.3.2 Rep-PCR分子鉴定
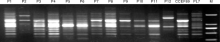
将杏鲍菇PL7和平菇CCEF89、融合菌株P1~P12分别用REP-1R、REP-2I、BOX、ERIC引物进行Rep-PCR扩增, 利用1.2%琼脂糖凝胶电泳检测PCR扩增产物, 分析融合菌株与亲本菌株的共有条带和差异条带, 采用DPS (version 7.05版)软件聚类距离Jaccard计算遗传距离, 利用0-1数据系统聚类UPGMA法进行聚类分析, 建立聚类树状图。结果表明, 所有融合菌株都产生了与亲本菌株不同的扩增条带(图4), 即具有与亲本菌株不同的基因型。聚类分析结果表明, 供试菌株间遗传距离为0.142 9~0.805 6, 平均遗传距离为0.500 8, 表明供试菌株间有较明显的遗传差异(图5)。当遗传距离为0.530 0时, 可将融合菌株和亲本分为4类:第1类为PL7; 第2类包括CCEF89、P2、P3、P4、P5、P6、P8、P9、P10、P12; 第3类包括P7、P11; 第4类为P1。聚类分析结果表明, 通过原生质体融合, 产生了与亲本菌株有显著区别的新型基因型的菌株。
2.4.1 子实体鉴定结果
出菇试验和子实体鉴定结果表明, 融合菌株P1、P5为杏鲍菇, 菇盖颜色较亲本PL7深, 菌柄较短, 略呈保龄球状。其余10个融合菌株均为平菇, 小菇蕾为黑色, 随着子实体长大, 9~12 ℃时菇盖为深褐色、黑色, 26~28 ℃时菇盖为浅褐色至褐色, 与亲本CCEF89不同的是菇盖表面有一层胶质。
2.4.2 杏鲍菇新菌株的栽培特性分析
出菇试验显示, 杏鲍菇新菌株P1、P5第1茬菇产量比亲本菌株PL7分别提高了16.1%和22.6%, 总生物学效率分别提高了19.5%和22.6%(出菇情况见图6)。制备300袋以棉籽皮为唯一基质的栽培袋, 每袋装干料500 g, P1、P5和PL7菌株分别接种100袋后进行栽培培养, 15 d后测定其污染率。结果发现, 与亲本菌株PL7相比, 杏鲍菇新菌株P1、P5栽培袋的污染率分别下降了38.2%和41.1%, 抗杂能力显著提高(表1)。
| 表1 杏鲍菇新菌株与亲本菌株的栽培特性比较 Table 1 Cultivation characteristics comparison of new strains and the parent strain of P. eryngii |
2.4.3 平菇新菌株的栽培特性分析
平菇融合菌株在原种培养基和栽培种培养基中菌丝呈白色, 粗壮浓密。除了P3、P6、P7、P9外, 其他6个菌株长满培养料的时间比亲本CCEF89显著减少, 平均缩短3.2~4.3 d。除了P3、P6、P7、P8、P9外, 其他5个菌株形成原基的时间比亲本CCEF89显著减少, 平均缩短4.3~7.3 d; 总生物学效率提高12.11%~27.67%, 出菇情况见图7。第1茬平均产量增加0.05~0.12 kg· 棒-1(干料500 g), 提高10.0%~24.0%。其中P4、P10、P11表现优异, 被确定为平菇优良新菌株。
| 表2 平菇新菌株与亲本菌株的栽培特性比较 Table 2 Cultivation characteristics comparison of new strains and the parent strain of P. ostreatus |
原生质体融合技术可以打破细胞壁障碍, 提高基因重组频率; 因此, 在创新种质资源和培育食用菌品种方面具有操作简单、周期短、目标明确、遗传性状稳定等优势[12]。随着原生质体融合技术的发展, 目前已经实现了食用菌种内、种间、属间, 甚至科间的原生质体融合, 并选育出了许多食用菌新品种, 例如康林芝等[4]利用金针菇(Flammulina velutipes)与平菇(P.ostreatus)原生质体融合, 选育出了金针菇新品种F1P8。在原生质体融合育种方面, 平菇是应用最广的食用菌品种, 与松乳菇(Lactarius deliciosus)[13]、香菇(Lentinus edodes)[14]、秀珍菇(P. pulmonarius)[15]、红平菇(P. djamor)[16]等许多食用菌都有关于原生质体融合育种的报道。本文利用杏鲍菇与平菇进行原生质体融合, 成功获得了具有双亲优良性状的融合菌株, 说明平菇具有优良的遗传特性, 非常适合作为原生质体融合的种质材料。
原生质体融合主要有化学法、电融合、激光诱导融合3种方法[12]。电融合和激光诱导融合虽然融合率较高, 但对仪器设备和融合技术的要求也高, 因此, 在实践过程中, PEG-Ca2+化学法的应用更广泛。本文结果表明, 平菇与杏鲍菇原生质体(1× 106 mL-1)按数量比1: 1混合后, 在30% PEG 6000和0.01 mol· L-1 Ca2+作用下, 32 ℃水浴30 min, 融合率可达0.010 1%~0.028 2%。该结果与秀珍菇和榆黄蘑原生质体融合的适宜条件(35% PEG 4000, 30 ℃水浴60 min)[17]、松乳菇与平菇原生质体融合的适宜条件(2种原生质体数量按1: 1混合, 30% PEG 4000, 30 ℃融合30 min)[13]相似, 但融合率比松乳菇与平菇原生质体融合(0.004 85%)提高了2.08~5.81倍。
目前采用的半灭活或双灭活原生质体融合技术, 主要是有利于筛选融合子。采用的原生质体灭活方法主要是热灭活、紫外线灭活和化学药剂灭活, 即采用物理或化学的方法使原生质体既保持染色质活力又失去再生能力[18, 19]。但是找到适于某一杂交组合的物理或化学方法, 是一个既耗时又耗力的工作, 因为很多物理或化学因素都会造成染色体损伤, 从而影响融合率和融合菌株的遗传稳定性。本文采用的非灭活原生质体融合技术, 保持了两亲本的原生质体活力, 使亲本的优良遗传基因能够在融合过程中得到完整地保存和传递, 并且通过拮抗反应试验、Rep-PCR分子检测和出菇试验可以准确地鉴定融合菌株, 能够同时获得2个亲本性状均得到改良的新菌株, 减少了外界因素对融合过程的影响, 并且提高了育种效率, 可获得更多的种质资源, 更有利于新品种的筛选和鉴定。本文采用非灭活的原生质体融合技术, 获得了12株平菇与杏鲍菇的原生质体融合菌株, 并且筛选出了具有双亲优良性状的2个杏鲍菇新菌株和3个平菇新菌株, 节约了育种时间和育种成本, 提高了育种效率, 有利于同时进行2种不同食用菌的种质资源创新和新品种选育。
(责任编辑 侯春晓)
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|