作者简介:葛金涛(1987—),男,山东安丘人,硕士,助理研究员,主要从事果树遗传育种研究。E-mail:672643419@qq.com
葡萄气生根是在高温高湿环境下老蔓上发育形成的一种特殊根系类型,发育程度较低,具有分化潜力。通过技术手段诱导魏可葡萄当年生结果枝茎节处萌发气生根,以同一结果母枝未处理茎节为对照进行根系转录基因表达情况分析,结果表明,诱导气生根发育过程中有3 989个基因表达量上升,2 830个基因表达量下调。采用GO功能分类,可将注释的基因划分为40个功能类别,包括催化活性、结合和代谢过程等。部分根系关键基因表达结果表明,生长素、赤霉素、脱落酸在内的所有植物激素都参与了调控过程,结合生长素下游相应基因分析,内切葡聚糖酶基因、 PRE基因和高亲和力硝酸盐转运体基因在气生根发育过程中显著上调表达,表明降解茎节处表皮细胞壁、利用硝酸盐在茎节处富集刺激根芽萌发是气生根生长发育调控机理之一。
Aerial root is a special type of root in grape which grows under high temperature and high humidity. The aerial root has low developmental degree and high potential for differentiation. In this study, techniques were used to induce aerial germination and rooting at the stem nodes of the fruiting branch of Weike grape, and the expression of root transcription genes was analyzed with the untreated stem nodes of the same mother branch as the control. The results showed that the expression of 3 989 genes was increased and the expression of 2 830 genes was down-regulated during the induction of aerial roots. GO functional classification was used to classify annotated genes into 40 functional categories, including catalytic activity, binding, and metabolic processes. Parts of the root key gene expression results showed that all plant hormones including auxin, gibberellin and abscisic acid were involved in the regulation process. Combined with corresponding gene analysis of auxin downstream, endoglucanase, PRE gene and high-affinity nitrate transporter gene significantly up-regulated in the aerial root development, indicating that the degradation of epidermal cell wall at stem nodes and the enrichment of nitrate at stem nodes to stimulate root germination were important regulatory mechanisms for the growth and development of aerial roots.
为了适应复杂的外界环境, 植物会通过改变器官结构来获取更大的生存空间, 其中根系结构的可变差异尤为显著[1]。根据发育时期不同, 根系产生了主根、侧根和不定根[2]。为适应不同的生长环境, 产生了土培根系、水培根系和气生根系的差异[3, 4]。植株感受外界环境刺激产生生物学信号, 进而导致一系列激素含量产生变化, 根系结构随之发生改变[5, 6]。影响根系结构发生变化的因素包括外源植物激素、盐胁迫、水胁迫、根际微生物侵染、虫害侵袭和营养元素等方面[7, 8]。其中, 生长素被认为是植物根系发育的最重要的调节因子之一[9], 近年来脱落酸在逆境条件下影响根系发育的研究也逐渐增多[10]。
葡萄是深根性植物, 根系肉质且发达, 具有固定植株、吸收水分和营养物质的作用, 还可以贮藏养分, 合成包括激素在内的多种活性物质以调控植株的生长发育。除此之外, 葡萄在栽培过程中, 如遇高温高湿环境, 会在老蔓上发育形成气生根(图1-A), 该类根系与栽培根系结构不同, 具有一定吸收空气的功能[11]。在生产上, 可利用葡萄容易产生气生根的特性, 采用高空压条技术繁育葡萄植株, 这表明葡萄气生根发育程度较低[12], 具有较强的分化潜能。因此, 葡萄气生根是一种较好的研究根系发育过程的材料。根系的形态建成是一个复杂的调控过程, 但目前关于葡萄根系发育相关基因及调控机理研究却很少。本实验通过高空压条技术, 利用净水诱导葡萄初生根形成, 通过转录组测序分析, 研究葡萄根系在形态建成初期基因调控机理, 以期为根系发育机理研究提供参考。
 | 图1 气生根类型 A, 在高湿环境中自然生成的气生根; B, 经诱导生成的气生根。Fig.1 Aerial roots type A, Natural aerial roots in high humidity environment; B, Induced aerial roots. |
以5年生魏可葡萄结果枝条为材料, 在当年生结果枝上选取一个已木质化的茎节, 在其生物学下端1 cm处环割, 保湿材料裹敷环割处进行保湿催生[12]。处理20 d后, 选取气生根初步形成的茎节(图1-B)作为实验材料, 以未环割的茎节作为实验对照, 液氮速冻后保存备用。
对照茎节(CK)和有初生根生成茎节(WK)转录组测序后, 分别得到53 773 228, 53 318 244条Raw reads, 去除接头(adapter)序列、5'或3'末端质量值低于20或者含N碱基、去除trim后reads长度低于750 bp的序列, 分别得到53 458 342, 53 001 586条Clean reads, Q20的百分率(计算Phred数值大于20的碱基占总体碱基的百分比)分别为97.43%和97.37%, Q30的百分率分别为93.50%和93.33%, 均大于90%, 质量合格。GC(计算碱基G和C的数量占总碱基数量的百分比)分别为46.12%和47.78%, N百分率(不确定碱基的比例)分别为0.001 033%和0.001 010%, 上述数据表明, 本次测序质量较好, 符合后续分析要求(表1)。
| 表1 测序质量统计 Table 1 Quality statistics of sequencing |
将过滤后的测序Clean data与参考基因组进行比对分析发现, 对照茎节(CK)和有初生根生成茎节(WK)的Clean reads中能定位到基因组上的序列(total mapped)分别为45 194 093和44 004 355, 占Clean reads比率为84.540 8%和83.024 6%(表2), 其中对照组和实验组有多个比对位置的测序序列(multiple mapped)分别为2 985 501(占比5.58472%)和2 499 067(占比4.715 08%), 在参考基因组序列上有唯一对比位置的测序序列分别为42 208 592(占比78.956%)和41 505 288(78.310%), 测序序列分段比对到参考序列两个外显子的序列(splice reads)分别为16 445 551和16 014 719, 测序序列整段比对到外显子的序列(non_splice reads)分别为25 763 041和25 490 569。
| 表2 Clean reads 比对到参考基因组上情况 Table 2 Clean reads aligned to the reference genome |
用ASprofile(V1.0.4)软件对StringTie (v1.0.4)[13]预测出的转录本进行可变剪切事件分类和表达量统计(图3)。其中实验组WK可变剪切最多的是TSS(最后一个外显子可变剪切, 16 689个可变剪切位点)、TTS(第一个外显子可变剪切, 15 125个可变剪切位点)和AE(可变5'或3'端剪切, 6 179个可变剪切位点), 对照组CK也表现相似的分布, TSS、TTS和AE分别为16 486、14 968和7 176个可变剪切位点(表3)。
| 表3 可变剪切统计 Table 3 Variable shear statistics |
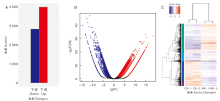
对检测结果按照差异显著性标准(差异基因表达变化2倍以上且FDR≤ 0.05)进行筛选, 在诱导葡萄初生根发育过程中, 有3 989个基因表达量上调, 2 830个基因表达量下调(图4)。
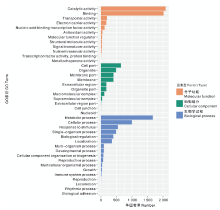
根系差异表达基因根据GO功能分类, 可分为分子功能(molecular function)、细胞组分(cellular component)及生物学过程(biological process)3大类(图5), 涉及40条功能分支, 其中, 参与催化活性(catalytic activity)与结合(binding)的样本基因数量最多, 都在2 000条以上。其次参与代谢过程(metabolic process)的基因数超过1 500条, 其余功能分支基因数都不超过1 000条。
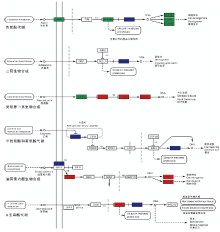
为进一步分析差异表达基因的生物学行为, 结合KEGG数据库, 对葡萄气生根发育表达基因的Pathway注释进行分析。结果显示, WK所富集的植物激素信号转导途径中色氨酸代谢ARF下调表达; 二萜生物合成途径TF基因家族下调表达; 类胡萝卜素合成中PP2C 、SnRK2和ABF上调表达; 半胱氨酸和蛋氨酸代谢中ETR和ERF1/2下调表达; 油菜素内酯生物合成中BAK1下调表达, BSK、TCH4和CYCD3上调表达; α -亚麻酸代谢中JAZ上调表达, MYC2下调表达(图6)。
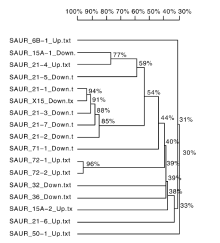
生长素作为调控植株生长发育最重要的激素, 在葡萄气生根发育过程中也起到重要调控作用, 其中生长素输入载体AUX1家族基因显著上调, Auxin transporter-like protein 2与Auxin transporter-like protein 3基因分别上调表达10.40倍和4.65倍。生长素输出载体是一种复合物, 由调节亚基-NPA结合蛋白和催化亚基-PIN(Pin-formed)蛋白组成[14]。PIN(auxin efflux carrier component)蛋白家族有8个成员, 本研究中发现PIN2与PIN1b显著上调, 而PIN3, PIN5和PIN8蛋白基因显著下调(表4)。而早期响应生长素的基因分为Aux/IAA(auxin/indole-3-acetic)[15]、GH3(gretchen hagen 3)[16]和SAUR(small auxin up RNA)[17]三大家族。在本实验中, SAUR基因家族有30个基因表达发生显著变化(表5), 其中包含13个具有SAUR基因家族类似功能的基因, 将剩余17个SAUR家族基因进行同源序列分析(图7), 发现除SAUR15A-1与SAUR21-4基因同源性为77%, 但表达上下调变化相反, 其余上调基因与下调基因分别归为一类。其中, SAUR71和SAUR72同属SUAR41亚家族, 属于CLADEⅢ , 在本研究中SAUR71基因表达下调, SAUR72基因表达上调。由此说明, 生长素在气生根发育过程中调控机理较为复杂, 生长素响应基因调控不同的代谢途径, 即使调控同一代谢途径, 同一基因家族会存在正向调控与负向调控的区别。
| 表4 PIN家族差异表达基因 Table 4 PIN gene family differentially expressed genes |
| 表5 SAUR家族差异表达基因 Table 5 SAUR gene family differentially expressed genes |
脱落酸是一种具有倍半萜结构的植物激素, 目前越来越多研究表明, ABA可以通过调控主根和侧根的生长发育使植物适应各种环境[18, 19]。在本文转录组测序研究中, 脱落酸受体PYR/PYL基因家族中PYL1、PYL4和PYL11显著上调, 而PYL9基因显著下调(表6)。PP2C(丝氨酸/苏氨酸残基蛋白磷酸酶)是一种脱落酸负调控因子, 该基因家族中Probable protein phosphatase 2C 24和Probable protein phosphatase 2C 75基因表达显著上调。SnRK2基因家族中Serine/threonine-protein kinase SAPK2基因表达显著上调, ABF基因家族中的Protein ABSCISIC ACID-INSENSITIVE 5基因表达显著上调, 都表明脱落酸密切参与了气生根发育调控。
| 表6 脱落酸响应基因差异表达 Table 6 Differential expression of abscisic acid response genes |
内切-β -1, 4-葡聚糖酶(endo-β -1, 4-D-glucanohydrolase)能催化水解纤维素等含有1, 4-β -葡聚糖主链的多聚糖, 降解成糊精或寡聚糖。研究发现, 植物的生长发育过程中内切-β -1, 4-葡聚糖酶发挥了广泛的作用, 如细胞伸长、果实成熟软化和组织器官脱落。本研究中内切葡聚糖酶1、3、5、6、10、11、17、24、25表达量显著上升, 只有内切葡聚糖酶12表达量下调(表7)。内切葡聚糖酶17上调表达量最高, 可能有侧根从茎节处萌发有关, 内切葡聚糖酶17降解了该处细胞壁[20]。
| 表7 内切葡聚糖酶家族基因差异表达 Table 7 Differential expression of endoglucanase family genes |
基本螺旋-环-螺旋(bHLH)转录因子(TF) PRE3/ATBS1/bHLH135/TMO7(以下简称PRE3)基因也发生了显著上调表达(log2FC值为13.40)。此外, 在本研究中3个高亲和力硝酸盐转运体NRT2.1a(high-affinity nitrate transporter 2.1-1 LOC100253304)、NRT2.1b(LOC100253304)和NRT2.4(LOC100263699)分别上调表达3 248、231和120倍。表明在葡萄气生根发育过程中, 通过硝酸盐转运体使硝酸盐在茎节处大量富集, 可显著提高茎节处侧根伸长[21]。
本实验选择葡萄气生根作为实验材料, 研究葡萄侧根发育相关基因的调控机理, 通过高通量分析, 对照茎节(CK)和有初生根生成茎节(WK)的Clean reads中能定位到基因组上的序列(total mapped)分别为45 194 093和44 004 355条。GO富集分析和KEGG富集分析, 阐明了气生根的发育调控过程中, 包括生长素、赤霉素、脱落酸在内的所有植物激素都参与了调控过程, 阐明了参与气生根发育调控的信号传导、激素调控等相关基因的表达差异, 尤其在生长素代谢调控通路和脱落酸代谢调控通路中, 差异表达基因富集显著, 且表达变化较大, 说明在气生根发育过程中生长素和脱落酸起到主要激素调控作用。
在植物根系发育过程中, 生长素(主要为吲哚乙酸)起到重要的调控作用[22]。生长素在植物组织间的运输方式有被动扩散和极性运输两种方式[23]。其中极性运输使生长素在植株体内形成以器官顶端为中心浓度梯度, 并维持植物不同组织中的生长素梯度差, 从而调控根的发育过程。生长素极性运输由生长素输入载体(auxun influx carrier)和生长素输出载体(auxin efflux carrier)调控。生长素输入载体介导生长素逆浓度梯度运输, 维持生长素浓度梯度差[24]。在本次实验中, 生长素输入载体AUX1家族基因显著上调, Auxin transporter-like protein 2与Auxin transporter-like protein 3基因分别上调表达10.40倍和4.65倍, 表明生长素被主动运输到了茎节处促进根系萌发, 生长素输出蛋白基因PIN2与PIN1b显著上调, 而PIN3、PIN5和PIN8蛋白基因显著下调, 表明生长素输出蛋白在植物生长发育过程中具有不同的生理功能。
在本次转录组测序中, 脱落酸响应基因显著表达, 表明脱落酸参与调控葡萄植株抵抗高温高湿环境, 并诱导葡萄植株茎秆萌发气生根来适应外界环境。而生长素响应基因的显著下调, 表明生长素表达量降低, 可能与脱落酸抑制生长素表达有关。结合生长素下游相应基因分析, 内切葡聚糖酶基因、PRE基因和高亲和力硝酸盐转运体基因在气生根发育过程中显著上调表达, 内切-β -1, 4-葡聚糖酶主要作用为催化水解纤维素, 这与气生根从茎秆处细胞萌发有关, 而PRE3基因是参与多种发育机制的转录因子, 包括光信号和激素稳定, 在本实验中, PRE3显著上调, 可能参与了赤霉酸或油菜素内酯调节初生根发育过程, 这与Castelain等[25]研究结果一致。此外, NRT2.1a、NRT2.1b和NRT2.4三个高亲和力硝酸盐转运基因均为极显著上调表达, 表明利用硝酸盐在茎节处富集, 刺激根芽萌发是气生根生长发育调控机理之一。
(责任编辑 张 韵)
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|