作者简介:孙筱君(1994—),女,湖北荆州人,硕士研究生,主要从事养殖粪污微生物处理研究。E-mail:531911993@qq.com
为了创制高效的粪污氨氮降解菌剂,特从猪粪中分离高效的氨氮降解微生物。通过感官法初筛,并结合氨氮降解率为指标进行复筛,最终获得高效氨氮降解菌株——Z2、AOZ和Y。经形态学观察、生理生化鉴定、16S rRNA基因序列分析,确定菌株Z2为弯曲芽孢杆菌( Bacillus flexus),菌株AOZ为恶臭假单胞菌( Pseudomonas putida),Y为干酪乳杆菌( Lactobacillus casei)。试验结果显示,菌株Z2和Y组成的复配菌剂对氨氮的降解效果最优,氨氮降解率高达53.19%,表明该复合菌剂可以应用于粪污除氨。
To obtain the ammonia-lowering agent for livestock manure, the bacterial strains with good ammonia-nitrogen-degrading capability were isolated from swine manure. Three strains with high ammonia-nitrogen degradation efficiency were identified with the olfactory threshold method combined with the comparisons of their ammonia-nitrogen degradation efficiencies, and were encoded as Z2, AOZ and Y, respectively. Based on the results of morphological observation, physiological and biochemical tests, and 16S rRNA sequence homology analysis, the strains Z2, AOZ and Y were identified as Bacillus flexus, Pseudomonas putida, and Lactobacillus casei, respectively. The experimental results showed that the ammonia-nitrogen degradation efficiency was higher when strains Z2 and Y were mixed, and the highest ammonia-nitrogen degradation efficiency reached 53.19%, suggesting that the microorganism complex could be practically applied to remove ammonium from swine manure.
随着人类社会的发展, 肉类消费需求迅猛增长, 养殖业也随之发展壮大。养殖业的飞速发展在给人们的生活带来方便的同时, 也带来了很大的环境问题。养殖业产生的废弃物已经成为主要的环境污染源, 其中, 恶臭气体和氮、磷污染问题尤为突出[1]。恶臭气体往往具有毒性, 会对生物体的健康产生不利影响[2]。畜禽养殖场散发的气味被许多人认为是最不愉快的气体[3]。目前已知的恶臭气体中浓度最高、对人类危害最大的是氨气和硫化氢[4]。尿液中的尿素通过脲酶水解, 在水性介质中会形成铵, 随后在浆液坑或尿水坑中挥发从而释放氨[5]。氨作为农业中最重要的污染物, 释放到大气中会导致酸化, 流入地表水会导致水体富营养化。
目前, 畜禽粪污氨氮去除技术多样, 包括化学、物理、生物等多种手段。其中, 物理、化学手段都需要较高的后续处理成本。相对而言, 生物法不仅具有更低的运营成本和投资成本, 而且降解效果较优[6], 具备高效、简单、环保等优点, 在畜禽养殖氨氮降解方面前景广阔。采用微生物降解粪污氨氮是生物法除臭的重要途径, 其中, 高效的氨氮降解菌株筛选是关键。为此, 本试验通过筛选高效的氨氮降解微生物并进行复配, 形成高效的氨氮降解复合菌剂, 以期为畜禽粪污的无害化处理提供技术依据与参考。
猪粪样本采集于浙江省安吉县某猪场, 均匀混合后自然风干。供试菌株Z2、ZH14、AOZ、Y3、Y均为本实验室保藏菌株。
氨氮降解菌富集培养基(简称为富集培养基):硫酸铵 2.0 g、氯化钠0.3 g、七水硫酸亚铁0.03 g、磷酸氢二钾1.0 g、七水硫酸镁0.03 g、氯化钙7.5 g、蒸馏水1 000 mL, pH值7.2。121 ℃灭菌30 min。
LB培养基:酵母粉5.0 g、蛋白胨10.0 g、氯化钠5.0 g、蒸馏水1 000 mL, pH值7.0。121 ℃灭菌30 min。
YPD培养基:酵母粉10.0 g、蛋白胨20.0 g、葡萄糖20.0 g、蒸馏水1 000 mL, pH值7.0。115 ℃灭菌15 min。
MRS培养基:蛋白胨10.0 g、牛肉膏10.0 g、酵母粉5.0 g、磷酸氢二钾2.0 g、葡萄糖20.0 g、乙酸钠5.0 g、柠檬酸氢二铵2.0 g、七水硫酸镁 0.58 g、一水硫酸锰0.25 g、蒸馏水1 000 mL、吐温80 1 mL, pH值6.2~6.4。121 ℃灭菌30 min。
光合细菌培养基:氯化铵1.0 g、醋酸钠3.5 g、氯化镁0.1 g、磷酸二氢钾0.6 g、磷酸氢二钾0.4 g、酵母粉0.1 g、蒸馏水1 000 mL, pH值7.2。121 ℃灭菌30 min。
沙堡弱葡萄糖(SDA)培养基:蛋白胨10.0 g, 葡萄糖40.0 g、蒸馏水1 000 mL。115 ℃灭菌20 min。
孟加拉红培养基:蛋白胨5.0 g、葡萄糖10.0 g、磷酸二氢钾1.0 g、七水硫酸镁0.58 g、孟加拉红0.033 g、氯霉素0.1 g、蒸馏水1 000 mL。121 ℃灭菌20 min。
以上培养基无特殊说明时, 在使用时均系液体培养基。若为固体培养基时, 均须额外添加琼脂粉, 琼脂的质量浓度统一设定为20 g· L-1。
氨气吸收液[c(H2SO4)=0.005 mol· L-1]:量取2.8 mL浓硫酸加入水中, 并稀释至1 L, 临用时再稀释10倍[7]。
酒石酸钾钠溶液(500 g· L-1):称取50 g酒石酸钾钠(KNaC4H4O6· 4H2O)溶于100 mL水中, 煮沸, 使约减少20 mL为止, 冷却后, 再用水稀释至100 mL。
纳氏试剂:称取17 g二氯化汞(HgCl2)溶于300 mL水中, 另称取35 g碘化钾(KI)溶解在100 mL水中, 然后将二氯化汞溶液缓慢加入到碘化钾溶液中, 直至形成红色沉淀不溶为止。再加入600 mL氢氧化钠溶液(200 g· L-1)和剩余的二氯化汞溶液。将此溶液静置1~2 d, 使红色混浊物下沉, 将上清液移入棕色瓶中用橡皮塞塞紧, 保存备用。
氨标准贮备液:称取0.314 2 g经105 ℃干燥1 h的氯化铵(NH4Cl), 用少量水溶解, 移入100 mL容量瓶中, 用氢气吸收液稀释至刻度。此溶液每1 mL含1.00 mg氨。
氨标准工作液:临用时, 将氨标准贮备液用氨气吸收液稀释至每1 mL含4.00 μ g氨。
1.4.1 氨氮降解菌株的富集驯化
取5 g风干猪粪接入到100 mL富集培养基, 30 ℃、220 r· min-1摇床振荡培养, 检测到铵根离子消耗完毕后, 转接5 mL至新鲜的富集培养基中, 连续富集4次。
将猪粪缺氧自然发酵后, 刮取5 g带霉菌样品接入100 mL SDA培养基, 30 ℃、静置培养3~7 d, 观测到培养液浑浊、内含丝状体后, 转接5 mL培养液至新鲜的SDA培养基中, 连续转接4次。
1.4.2 氨氮降解菌株的分离纯化
将细菌富集液稀释涂布富集培养基固体平板, 在30 ℃恒温培养箱内培养3~5 d, 挑取特征不同的菌落分离纯化, 4 ℃冰箱保存备用。
取真菌富集液涂布于孟加拉红培养基固体平板上, 在30 ℃恒温培养箱内培养3~5 d, 挑取特征不同, 且菌落为非红色的丝状菌落划线分离, 4 ℃冰箱保存备用。
1.4.3 氨氮降解菌株的筛选
(1)初筛。取新鲜的猪粪200 g置于1 000 mL大烧杯中, 按0.1 mL· g-1的接种量将重悬菌液接种于烧杯中, 用玻璃棒将培养液与猪粪混合均匀, 保鲜膜封口。对照组补加等量的无菌水。每组3个重复, 30 ℃静置培养7 d, 通过感官法[8]初步判断菌株的氨氮降解效果。
(2)复筛。取初筛得到的菌株进行复筛试验。取新鲜的猪粪200 g置于1 000 mL大烧杯中, 按0.1 mL· g-1的接种量将菌株接种于烧杯中, 用玻璃棒将菌液与猪粪混合均匀, 内置装有20 mL氨气吸收液的小烧杯, 保鲜膜封口。对照组补加等量的无菌水。每组3个重复, 每隔3 d取走小烧杯, 测量吸收液内含有的氨氮, 并更换新的吸收液。利用纳氏试剂检测法测定氨氮的释放量, 计算氨氮降解率, 确定氨氮降解率较高的菌株。
1.4.4 氨氮降解菌株的鉴定
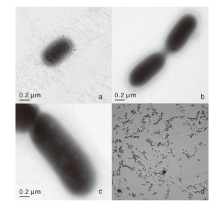
将筛选得到的菌株划线到PDA培养基固体平板上, 30 ℃恒温培养48 h后, 进行形态学观察和生理生化鉴定。对于细菌菌株, 使用Hitachi H7650透射电子显微镜(日本日立)观察其亚显微结构; 对于真菌菌株, 使用MicroPublisher 5.0 RTV光学显微镜(美国QImaging)观察水浸片上的真菌细胞形态。挑取菌落加入装有PCR体系的PCR管中, 进行16S rRNA基因扩增。所用引物为原核生物16S rRNA PCR通用引物27F与1492R, 正向引物序列为5'-agagtttgatcctggctcag-3', 反向引物序列为5'-acggctaccttgttacgactt-3'。引物由生工生物工程(上海)股份有限公司合成。PCR体系包括10× transtaq缓冲液5 μ L(含有15 mmol· L-1的Mg2+)、dNTP(2.5 mmol· L-1)4 μ L、上下游引物(10 μ mmol· L-1)各0.8 μ L、DNA模板2 μ L(约30 ng)、Taq酶0.4 μ L, 用ddH2O补至50 μ L。PCR程序:94 ℃预热4 min; 94 ℃变性1 min, 55 ℃退火1 min, 72 ℃延伸1 min, 31个循环; 72 ℃保持5 min, 4 ℃保存。扩增结果送至生工生物工程(上海)股份有限公司进行测序。将所得结果在NCBI数据库上进行同源性比对分析, 并用MEGA程序构建系统进化树, 确定菌种。
1.4.5 氨氮降解菌株的拮抗试验
将优势菌株通过划线交叉法, 在YPD培养基固体平板上两两之间进行交叉划线, 观察交叉点是否有菌生长, 两者均可以生长则不拮抗, 1株或2株不能生长则为拮抗。
1.4.6 氨氮降解菌株的复配
取新鲜的猪粪200 g置于1 000 mL大烧杯中, 按0.1 mL· g-1的接种量将重悬菌液接种于烧杯中, 用玻璃棒将培养液与猪粪混合均匀, 内置装有20 mL吸收液的小烧杯, 保鲜膜封口, 依前述试验结果选定菌株后, 除去相互拮抗关系, 将其相互组合, 对照组补加等量的无菌水, 每组3个重复, 每隔3 d取走小烧杯测量吸收液内含有的氨氮, 更换新的吸收液。
1.4.7 氨标准曲线与样品测定
取7支10 mL具塞比色管, 依次加入0、1.00、2.00、4.00、6.00、8.00、10.00 mL的氨标准工作液, 使用无氨水定容至10 mL标线后, 在各管中按顺序加入0.2 mL酒石酸钾钠溶液和0.2 mL纳氏试剂, 混匀, 静置10 min。于波长420 nm处, 使用酶标仪测定吸光度。以吸光度(扣除空白组数据后)对氨浓度(mg· L-1)绘制标准曲线。
样品测定时, 将10 mL样品原溶液或稀释至合适浓度的稀释溶液加入具塞比色管中, 使用制备标准曲线的操作步骤测定样品的吸光度。用10 mL吸收液作试剂空白进行测定。
应用SPSS 18.0软件对试验数据进行统计分析。
从安吉某猪场采集的粪污, 经过富集培养基的富集驯化后, 通过划线法分离菌株, 经多次纯化, 共分离得到13株可以降解氨氮的菌株, 将其中的细菌菌株分别命名为N1~N6, 真菌菌株分别命名为M1~M7。通过感官法初步测定各菌株对猪粪氨氮的降解效果, 结果如表1所示。根据感官筛选法, 具备一定氨氮降解能力的菌株为N2~N6和M1~M7。但是感官方法无法进一步明确菌株的氨氮去除效果, 因此, 选择上述菌株进行复筛。
| 表1 供试菌株的感官臭气评价 Table 1 Sensory evaluation of malodorous gas of test strains |
| 表2 细菌菌株的生理生化特性 Table 2 Physiological and biochemical characteristics of bacterial strains |
以不添加菌剂的组别作对照, 将初筛得到的菌株, 与实验室保藏的菌株Z2、ZH14、AOZ、Y3、Y进行复筛试验, 在实验室培养条件下测定各菌株对氨氮的去除效果, 计算不同时间各菌株对氨氮的降解率。细菌筛选结果见图1, 真菌筛选结果见图2。
 | 图1 不同细菌菌株在第3、6、9天的氨氮降解率Fig.1 Ammonia-nitrogen degradation rates of different bacteria strains on day 3, 6 and 9 |
 | 图2 不同真菌在第3, 6, 9天的氨氮降解率Fig.2 Ammonia-nitrogen degradation rates of different fungi strains on day 3, 6 and 9 |
由图1可以看出, 在复筛试验中, 筛选菌株降解氨氮的能力普遍低于实验室保藏菌株。整个试验过程中, 9 d时Z2菌株的氨氮降解率最高(47.43%)。此外, AOZ、Y菌株的氨氮降解效果亦较好, 最高氨氮降解率分别为43.28%和44.91%。
真菌复筛的结果如图2所示。M4菌株整体表现良好, 9 d时氨氮降解率最高(46.31%), 其余真菌菌株的氨氮降解率表现一般。
综上, 选取菌株Z2、AOZ、Y和M4作为复合氨氮降解菌剂的功能菌株, 进行后续复配试验。
对菌株M4、Z2、AOZ、Y进行菌落PCR, 扩增得到16S rDNA片段, 测序结果提交到GenBank数据库, 相应的登录号(accession number)分别为MT322238、MT322305、MT322306和MT322307。在NCBI数据库上进行BLAST序列比对, 通过MegaX构建系统发育树进行同源性分析, 结果如图3所示。结合菌落形态观察(图4)、细菌菌株的生理生化分析, 确定菌株Y为干酪乳杆菌(Lactobacillus casei), Z2为弯曲芽孢杆菌(Bacillus flexus), AOZ为恶臭假单胞菌(Pseudomonas putida)。真菌菌株M4具有尿素分解、尸胺分解和产脂的能力, 可利用葡萄糖与氨, 可基本确定M4为Dipodascus macroporus。将Z2菌株保藏于中国典型培养物保藏中心(CCTCC), 保藏号为M2018659。
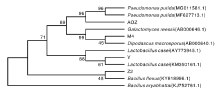 | 图3 基于16S rDNA的菌株Z2、AOZ、Y、M4系统发育树Fig.3 Phylogenetic tree of strain Z2, AOZ, Y and M4 based on 16S rDNA |
将得到的优势菌株Z2、AOZ、Y、M4进行拮抗试验。结果显示, 菌株M4与其他3株菌均有拮抗关系, 故其不参与复配。但要指出的是, 本研究中, 拮抗试验通过对峙培养法进行, 该法不能有效地控制菌株的生长量, 故而无法判断是营养竞争抑制还是其代谢物产生的拮抗作用。
将Z2、AOZ、Y按1∶ 1的比例进行复配, 形成4组(Z2+Y、Y+AOZ、Z2+AOZ、Z2+Y+AOZ), 进一步进行氨氮降解组合的筛选。以空白对照组的氨氮释放量为参照, 计算各个组合的氨氮降解率。如图5所示, 不同组合的氨氮降解率存在一定差异, 多菌组合对氨氮的去除效果一般, 组合Z2+Y对氨氮的去除效果最好, 9 d时氨氮降解率达到48.07%。
为检验复合菌剂Z2+Y对猪粪氨氮的降解效果, 设置不同的菌剂添加量(浓度梯度依次为0.01、0.03、0.05、0.10、0.15 mL· g-1)进行氨氮降解试验, 结果如图6所示。可以看出, 各菌剂添加量下试验前期氨氮降解率均随着时间的延长而提高, 至第6天时氨氮降解率最高, 而后随着时间的延长降解率显著(P< 0.05)降低。当菌剂接种量为0.01~0.03 mL· g-1时, 菌株对氨氮的降解率随着添加量的增大而增大, 当接种量为0.03~0.10 mL· g-1时, 接种量的提升, 并未提高菌株对氨氮的降解率, 部分时间段存在降低的现象, 当接种量从0.10 mL· g-1提升至0.15 mL· g-1时, 菌株对氨氮的降解率显著(P< 0.05)降低。当菌株投加量为0.10 mL· g-1时, 有部分时间段(3、6 d)除臭效果最优, 但综合全程除臭效果和成本考虑, 选择0.03 mL· g-1为菌剂最佳接种量。
本研究选取猪粪作为筛选来源, 筛选氨氮降解功能菌株, 结合实验室现有保藏菌株, 通过组合优化进行猪粪的氨氮降解试验, 确定Z2+Y为最优菌剂组合, 氨氮降解率最高可达53.19%。经鉴定, Y为干酪乳杆菌, Z2为弯曲芽孢杆菌。
许多微生物都参与了氨氮降解的过程, 如欧洲亚硝化单胞菌(Nitrosomonas europaea)、硝化球菌(Nitrococcus mobiles)等菌株被发现可有效去除猪粪中的氨氮[9]。研究表明, 微生物改良剂在降低粪便pH值的同时, 大大降低了氨氮含量。其中, 功能微生物如乳杆菌属会产生有机酸, 在降低猪粪pH值的同时, 有机酸还可以抑制尿素(或尿酸)的水解和有机氮的脱氨, 从而降低氨氮含量[10, 11]。Li等[12]发现, 促进氨气生成的巴氏杆菌(具有脲酶活性的尿素分解菌)在酸性条件下无法生长; Lam等[13]将脲酶抑制剂应用于澳大利亚的亚热带牧场, 发现氨氨的挥发减少了44%。芽孢杆菌属由于抗逆性强、繁殖速度较快[14], 在环境微生物领域应用较广。翟继鹏等[15]的研究显示, 芽孢杆菌属在恶臭气体去除方面也有重要作用。Yumoto等[16]在筛选去除动物粪便相关异味的菌株时, 分离出了新的物种, 将其命名为Bacillus asahii sp. nov。本研究从猪粪中筛得的弯曲芽孢杆菌Z2的氨氮降解率为47.43%, 低于李玥等[17]从鸡粪中筛得的芽孢杆菌属菌株MS03, 推测菌株的降解能力可能与其来源有关。芽孢杆菌属的代谢产物对一些物质也有去除作用。如地衣芽孢杆菌菌株TAB7是用于堆肥除臭的商业菌株, Mpofu等[18]测试了其对部分酚类的生物转化能力, 结果显示, 其可以转化阿魏酸盐, 并通过基因组分析证明其具有与酚类化合物分解代谢有关的基因序列, 在具有除氨氮功能的同时, 还可分解转化其他恶臭气味来源。
单一菌株的降解能力往往低于多种菌株共同作用的效果。Meinen等[19]利用筛选的除臭菌株混合培养后得到一种除臭剂, 对畜禽粪便有较强的除臭能力, 且其除臭效果优于任一单个菌株。韩保安等[20]将筛选得到的4株菌株进行复配, 利用复合微生物菌群提高了氨氮去除效率。本研究对3株功能菌株进行复配, 结果显示Z2+Y菌株组合的氨氮降解能力最强, 降解率最高可达53.19%。其他复配组合的氨氮降解效果不明显, 甚至低于单一菌株的降解能力, 这可能是因为复合微生物中的某一菌株占据了绝对优势, 导致其对营养物质快速消耗, 影响了其他菌株的生长繁殖[21]。功能微生物的添加量也会影响其降解效果, 本研究中过高的接种量反而导致菌剂对氨氮的降解率降低。推测其原因, 可能是因为微生物添加量过大, 导致营养物质因被迅速利用而匮乏, 降低了功能微生物的生物活性和关键酶的活性[22]。Matusiak等[23]制作了微生物制剂与丝兰提取物用于脱氨, 微生物制剂中包含荧光假单胞菌(Pseudomonas fluorescens)、粪肠球菌(Enterococcus faecium)、枯草芽孢杆菌(Bacillus subtilis)、巨大芽孢杆菌(Bacillus megaterium)、肠膜明串珠菌(Leuconostoc mesenteroides)和鲁地链霉菌(Streptomyces rutgersensis), 添加丝兰提取物后, 经过96 h曝气, 粪便中的氨氮浓度降低了43.4%, 空气中的氨氮减少了64%, 当再添加微生物制剂联合应用时, 氨氮降解率提高至68.4%, 降解效率与本研究相当, 且与本研究均使用了芽孢杆菌。Borowski等[24]将荧光假单胞菌、粪肠球菌、枯草芽孢杆菌、巨大芽孢杆菌、肠膜明串珠菌和植物乳杆菌(Lactobacillus plantarum)制成喷雾干燥微胶囊, 吸附于珍珠岩膨润土混合物上, 当混合物中喷雾干燥微胶囊添加量为10%时, 对氨氮的平均去除率为86%, 添加量为20%时, 平均降解率为94%, 说明合适的载体可以提升微生物制剂的脱氨效果。这给本研究之后的应用提供了一定的启发。
总的来看, 本研究获得的复合菌剂组合Z2+Y在猪粪的氨氮降解方面有很好的效果, 可以实现农业生产中的氨氮高效去除, 有利于农业的可持续发展, 为畜禽粪污的无害化处理提供了一种高效的复合微生物制剂。但是复合菌剂的作用机理和2株功能菌株之间的协同机理还需深入研究。
(责任编辑 高 峻)
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|