作者简介:董宇飞(1996—),女,河南登封人,博士研究生,主要研究方向为蔬菜生长发育调控。E-mail: 1060844805@qq.com
以连作3年辣椒、大蒜-辣椒轮作、玉米-辣椒间作根际土壤为研究对象,探讨了大蒜-辣椒轮作和玉米-辣椒间作处理对连作辣椒土壤微生物群落和酶活性的影响,以期为缓解辣椒连作障碍提供理论依据。结果表明,与连作3年辣椒土壤相比,轮间作处理的土壤过氧化氢酶、脲酶活性显著提高,细菌、放线菌数量显著增加,真菌数量显著减少( P<0.05)。高通量测序结果表明,轮间作处理土壤微生物群落结构组成相似,但与连作3年土壤微生物结构差异较大,供试土壤中细菌优势种群为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria),并且酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidete)、浮霉菌门(Planctomycetes)和黄单孢菌目(Xanthomonada)在不同处理土壤中相对丰度差异显著;真菌优势种群为子囊菌门(Ascomycota)、担子菌门(Basidiomycota),其中镰刀菌属( Fusarium)、座囊菌纲(Dothideomycetes)、接合菌门(Zygomycota)在不同处理土壤中相对丰度差异显著( P<0.05)。此外,轮间作处理能够显著降低潜在病原菌的相对丰度并提高潜在有益菌丰度,从而改善土壤微生物结构,同时显著提高了土壤酶活性和土壤细菌群落多样性。
The effects of rotation and intercropping on soil microbial community and enzyme activity were studied by taking three years of continuous cropping of pepper, garlic-pepper rotation and maize-pepper intercropping rhizosphere soil as objects, which was expected to provide theoretical basis for relieving pepper continuous cropping obstacle. Results showed that rotation and intercropping significantly enhanced the activities of catalase and urease, and increased the biomass of bacteria and actinomycetes while the biomass of fungi was greatly decreased compared with continuous cropped soil ( P<0.05). According to high-throughput sequencing results, the soil microbial structure of rotation field was similar to intercropping soil but far different from continuous cropped soil. Findings revealed that Proteobacteria and Acidobacteria were dominant bacterial populations, while Ascomycota and Basidiomycota were leading fungi phylum among the tested soil. Moreover, the relative abundances of Acidobacteria, Bacteroidete, Planctomycetes, Xanthomonada and Fusarium, Dothideomycetes, Zygomycota among different treatments were much significant ( P<0.05). In conclusion, rotation and intercropping enhanced soil enzyme activity and soil bacterial community diversity. Besides, they improved soil microflora by reducing the relative abundance of potential pathogens while increasing the abundance of potential beneficial bacteria.
土壤连作会造成土壤养分不均衡, 土壤肥力降低, 植株根系活力下降, 植株长势变差[1]。据调查, 随着辣椒种植面积的扩大和连作年限的增加, 连作障碍日益严重, 轻者减产30%左右, 严重的减产60%以上, 甚至绝产[2]。连作障碍发生的原因很多, 其主要原因是连续单一种植同一作物导致作物根际微生态平衡失调、微生物种群结构失衡、微生物总数和土壤酶活性下降[3]。因此, 采用合理的耕作制度, 如不同作物合理轮作、适当作物间作等措施, 是提高土壤质量及作物产量的重要手段。
众多研究表明, 轮间作系统通过维持土壤微生物群落的多样性和活动, 抑制单一栽培中的有害微生物而增加有益微生物活性和数量, 提高土壤酶活性来提高作物产量[4, 5, 6]。比如, 西瓜与水稻水旱轮作的模式, 减少了土壤中的根结线虫, 降低了西瓜枯萎病及水稻纹枯病发病率, 改善了土壤的微生态系统[7]; 大蒜与油菜间作减轻大蒜白腐病发生[8]; Khan等[9]采用胡椒间作大蒜通过改变酶活性和土壤微生物种群来提高土壤肥力。栽培方式不同, 对土壤肥力和质量提升程度不同, 导致土壤可培养微生物数量、微生物种类和土壤酶活性也不同, 而这些差异又会对土壤生理生化性质及生产力产生重要影响, 因此, 土壤微生物生物量和酶活性等特性可以作为衡量土壤质量的生物指标[10]。
在辣椒生产中, 轮作或者间作有利于缓解连作障碍进而提高辣椒产量这一点早已广为人知并得以应用, 但对于轮作和间作有利的原因, 尤其是其土壤微生物学机制尚未明确。因此, 本研究主要从土壤微生物和酶活性方面探讨轮间作模式对于辣椒连作障碍的影响, 分析不同栽培模式辣椒土壤微生物结构和群落多样性差异, 以及轮间作处理对连作辣椒土壤酶活性的影响, 以期为克服辣椒连作障碍提供理论依据, 并且提供一定的实践指导。
供试土壤样品取自山东省德州市农业科学院, 试验在同一地区相邻地块共设9个小区, 进行连作3年辣椒、玉米-辣椒间作3年、大蒜-辣椒轮作3年3个处理, 每个处理各随机占3个小区, 小区之间由挑沟进行分隔, 供试辣椒品种为德红2号。在进行该试验之前, 各处理土壤化学特征相似:土壤pH值为7.96± 0.05, EC值为(773± 11)μ S· cm-1, 有机质含量为(11.712± 0.857)g· kg-1。试验地区50%以上为潮土类, 碱解氮含量属中等水平, 速效磷含量较高, 速效钾含量一般, 当地农民常规栽培管理。土壤样品的采集于2017年8月末辣椒成熟期进行。在每个处理小区按五点取样法随机取样, 即选择长势均匀并具有代表性的5株辣椒, 用直径约5 cm的土钻取距辣椒植株约5 cm处、0~20 cm深的根际土样作为一个样品, 混匀并挑除杂质放入取样袋带回实验室。之后一部分于4 ℃冰箱内冷藏用于稀释平板法测可培养微生物数量; 一部分置于阴凉处风干, 过2 mm筛用于土壤酶活性的测定; 另一部分样品装在灭过菌的50 mL离心管内置于-80 ℃超低温冰箱内冷冻保存, 用于高通量测序分析微生物群落结构。
1.2.1 土壤微生物数量测定
采用稀释平板计数法进行微生物检测[11], 细菌采用牛肉膏蛋白胨培养基培养, 选择10-4、10-5、10-6倍稀释度悬液涂平板, 每个稀释度均做3个重复, 在37 ℃条件下倒置培养2 d后计数; 真菌培养采用孟加拉红培养基, 选择10-1、10-2和10-3倍稀释度悬液涂平板, 每个稀释度做3个重复, 在28 ℃条件下倒置培养3~5 d后计数; 放线菌培养采用改良高氏一号培养基, 选择10-3、10-4和10-5倍稀释度悬液涂平板, 每个稀释度做3个重复, 在30 ℃条件下倒置培养5~7 d后计数, 并计算土壤中细菌和真菌数量的比值(B/F), 以反映土壤微生物区系结构; B/F比值降低, 导致土壤土传病害发生严重[12, 13]。
1.2.2 土壤酶活性的测定
土壤过氧化氢酶和土壤脲酶活性分别采用Solarbio公司土壤过氧化氢(S-CAT)检测试剂盒和Solarbio公司土壤脲酶(S-UE)检测试剂盒测定。
1.2.3 土壤微生物高通量测序
土壤微生物分析采用新一代高通量测序技术(high-throughput sequencing), 这一技术又称二代测序(next generation sequencing, NGS)或者平行测序(parallel sequencing), 可直接测序16S rRNA基因的PCR产物, 每次分析获得的基因序列数以百万甚至亿万计, 不仅通量高, 而且能够同时分析上百个不同的样品, 是解析复杂环境中微生物群落物种组成和相对丰度的重要工具, 已经成为环境微生物多样性检测的首选[14, 15]。Shannon-winner曲线是利用Shannon指数来进行绘制的, 反映样品中微生物多样性的指数, 利用各样品的测序量在不同测序深度时的微生物多样性指数构建曲线, 以此反映各样本在不同测序数量时的微生物多样性。
土壤微生物DNA提取采用E.Z.N.A. ® Soil DNA Kit试剂盒, 分别用真菌和细菌通用引物进行PCR扩增, 引物具体信息如表1所示, 对扩增产物切胶回收检测浓度后保存于-20 ℃用于后续的高通量测序。
| 表1 PCR扩增产物 Table 1 Primers used for PCR amplification |
如表2所示, 测试土壤中微生物群落中可培养的细菌数量最多, 其次是放线菌, 真菌数量最少, 而且不同种植模式对土壤三大类群微生物数量有显著的影响。不同种植模式土壤细菌数量变化为间作> 轮作> 连作; 土壤真菌数量变化为连作> 间作> 轮作; 土壤放线菌数量变化为轮作> 间作> 连作。与连作辣椒模式相比, 大蒜-辣椒轮作以及玉米-辣椒间作能够明显增加土壤细菌数量, 增幅分别为88.24%、112.61%; 土壤放线菌数量分别增加302.81%、156.25%; 土壤真菌数量分别减少51.74%、39.57%, 差异达到显著(P< 0.05)水平。
| 表2 不同种植模式土壤三大类群微生物数量变化 Table 2 Dynamic of three major microbial number of different planting patterns |
此外, 大蒜-辣椒轮作土壤中细菌和真菌数量的比值(B/F)最大, 玉米-辣椒间作土壤次之, 连作辣椒土壤最小, 说明轮作和间作处理均能促进土壤细菌增殖而抑制真菌增殖, B/F值升高。以上结果表明, 采用大蒜轮作和玉米间作能够有效改善辣椒根际微生物区系, 使根际微生物组成由真菌型向细菌型转变。
2.2.1 轮间作处理对连作辣椒根际土壤微生物多样性的影响
从表3的微生物多样性Shannon指数中可以看出, 各处理土壤细菌和真菌Shannon指数差异达到显著水平(P< 0.05)。与连作土壤相比, 轮作和间作处理能够显著增加土壤细菌群落Shannon指数, 增幅分别为6.84%、5.63%; 同时分别显著降低土壤真菌群落Shannon指数, 降幅分别为13.06%、5.23%。
| 表3 不同处理土壤细菌和真菌Shannon指数 Table 3 Shannon index of soil bacteria and fungi of different treatments |
2.2.2 轮间作处理对辣椒根际连作土壤微生物群落组成的影响
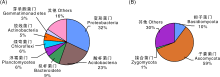
如图1所示, 所有样品中相对丰度大于1%的细菌按照其相对丰度的高低依次为(α -, β -, γ -, δ -)变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidete)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes), 其中(α -, β -, γ -, δ -)变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)为优势种群, 所有样品中它们相对丰度分别为32%、23%; 此外, 所有样品中真菌相对丰度从高到低依次为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota), 其中子囊菌门(Ascomycota)为优势种群, 占所有可测真菌群落的59%, 是供试土壤样品中主要的真菌类群。
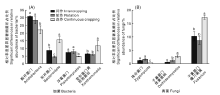
如图2-A所示, 不同处理土壤细菌群落中酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidete)、浮霉菌门(Planctomycetes)、黄单孢菌目(Xanthomonada)相对丰度差异较大。与连作3年相比, 轮作和间作处理显著提高了土壤酸杆菌门(Acidobacteria)的相对丰度, 增幅为27.91%、39.42%; 同时提高了浮霉菌门(Planctomycetes)的相对丰度, 增幅为61.22%、51.63%; 但显著降低了拟杆菌门(Bacteroidete)和黄单孢菌目(Xanthomonada)的相对丰度, 以轮作处理效果最为显著, 降幅分别为71.78%、47.86%。图2-B是不同处理土壤中相对丰度差异显著(P< 0.05)的三类真菌, 虽然子囊菌门座囊菌纲(Dothideomycetes)和接合菌门(Zygomycota)相对丰度较低, 但在不同处理土壤中相对丰度差异显著。与连作3年土壤相比, 轮间作处理显著降低了子囊菌门座囊菌纲(Dothideomycetes)和镰刀菌属(Fusarium)的丰度, 其中子囊菌门座囊菌纲(Dothideomycetes)的相对丰度分别减少56.36%、81.81%, 镰刀菌属(Fusarium)的相对丰度分别减少46.77%、36.62%, 但接合菌门(Zygomycota)相对丰度显著增多, 分别增加433.33%、283.33%。
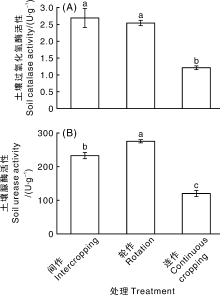
如图3所示, 与连作土壤相比, 玉米-辣椒间作和大蒜-辣椒轮作明显增加了土壤过氧化氢酶活性, 增幅分别为109.92%、122.31%, 此外, 轮间作处理也显著提高了土壤脲酶活性, 增幅分别为129.34%、93.67%, 以轮作效果更为明显, 差异达到显著(P< 0.05)水平。
大量研究表明, 许多作物连作会导致土壤理化性状变差、养分失衡等问题, 而采用嫁接、施用微生物菌剂, 以及合理的轮作、间作、填闲等栽培模式能够提高土壤微生物种群多样性和稳定性, 缓解连作障碍, 促进作物生长、增加产量。段曦等[16]采用嫁接的方式发现, 嫁接辣椒根系分泌物组分变化是其减轻土传病害的重要机理之一, 砧木和嫁接辣椒降低辣椒发病率, 产量分别比对照高31.7%和38.3%。祁红英等[17]进行了几种微生物菌剂对辣椒混合性土传病害的田间防效试验, 发现微生物菌剂AR156-2处理增产率达214.39%。本研究采用轮作和间作等不同的栽培模式发现, 大蒜-辣椒轮作和玉米-辣椒间作均显著改善了连作辣椒土壤微生物区系和土壤酶活性, 但其具体机理还有待进一步研究。
土壤微生物是土壤重要的组成部分, 参与土壤中物质的分解与转化, 对土壤肥力的形成及其在植物营养的转化中起着积极的作用。土壤微生物群落的多样性和丰富度都与其生态环境相关[18]。在本实验中, 大蒜-辣椒轮作和玉米-辣椒间作处理后辣椒土壤微生物群落数量发生了显著变化, 轮间作处理较连作土壤细菌显著增多, 增幅分别为88.24%、112.61%, 与此同时土壤放线菌数量增幅为302.81%、156.25%, 真菌数量显著减少51.74%、39.57%(表2)。杨凤娟等[19]在黄瓜上的研究也得出了类似结果。高通量测序结果进一步表明, 与连作土壤相比, 轮间作处理细菌群落多样性显著增加, 真菌相反(表3)。导致这一结果的原因可能是轮间作处理使土壤微生态环境及其可利用的营养发生了变化, 从而使微生物群落结构发生改变。以上结果表明, 轮间作处理使连作辣椒土壤微生物群落结构由“ 真菌型” 向“ 细菌型” 转变。我们推测这种变化可能与轮间作处理改善了土壤微生态环境和土壤营养水平有关。
土壤微生物中细菌和真菌的种类和数量最多, 其群落结构的改变与作物种类、土壤类型和养分、作物生长发育时期等密切相关。在细菌群落结构方面, 已有研究表明, 相比于马铃薯感病型土壤, 酸杆菌门在抑病型土壤中丰度较高[20]; Sanguin等[21]在连续种植了10年小麦的抑病型土壤中发现很多属于酸杆菌门、浮霉菌门的种群急剧增加, 并指出这几个门与土壤抑病功能密切相关; 拟杆菌的分布与土壤营养水平呈显著负相关[22]; 黄单孢菌目部分细菌是植物病原菌, 能够引起辣椒细菌性疮痂病。本实验中, 轮间作处理较连作土壤拟杆菌门(Bacteroidete)比例显著降低, 可能是与轮间作处理改善了土壤营养水平有关。此外, 酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)相对丰度显著升高, 而黄单孢菌目(Xanthomonada)相对丰度显著下降(图2), 推测这可能是轮间作处理可以缓解辣椒土传病害而连作土壤易发病的原因之一。在真菌群落结构方面, 已有报道表明, 作物土传枯萎病病原菌的相对丰度与真菌接合菌门呈负相关关系, 和真菌子囊菌门呈正相关关系[23]; 许多病原菌均属于子囊菌门, 部分镰刀菌属是土壤根际潜在病原菌, 可侵染植物维管束系统, 破坏作物输导组织维管束, 导致作物萎蔫死亡; 与甜瓜连作根际土壤相比, 茴香轮作根际土壤中镰刀菌属略有下降趋势[24]; 引起果实煤污病的大多数病原菌属于座囊菌纲[25, 26]。本实验中, 轮间作处理土壤真菌的接合菌门(Zygomycota)相对丰度较连作土壤显著升高, 可能是由于接合菌能够与高等植物共生形成菌根从而改良土壤微生态环境。此外, 我们还发现轮间作处理较连作土壤子囊菌门座囊菌纲(Dothideomycetes)和镰刀菌属(Fusarium)相对丰度显著降低, 推测轮间作处理缓解连作障碍的原因可能与抑制此类病原菌的发生有关。
土壤酶参与有机质的分解和腐殖质的形成, 是土壤生物活性的综合表现, 其催化土壤中的生物化学反应, 影响土壤养分的形成和积累[27, 28]。其中, 过氧化氢酶主要来源于细菌、真菌以及植物根系的分泌物, 它能破坏土壤中生化反应生成的过氧化氢, 将过氧化氢分解为水和氧, 减轻活性氧对植物的危害[29]。脲酶是一种对土壤有机态氮分解转化起非常重要作用的酶, 它直接参与尿素形态转化, 能够催化尿素水解生成氨、水和二氧化碳, 可以作为土壤生态系统变化的敏感指标, 其活性反映土壤有机态氮向有效态氮的转化能力和土壤无机氮的供应能力[30]。在本实验中, 与连作土壤相比, 大蒜-辣椒轮作处理和玉米-辣椒间作处理之后, 土壤过氧化氢酶活性和脲酶活性显著升高(图3), 推测轮间作栽培方式可能通过提高土壤过氧化氢酶和脲酶活性, 促进土壤有机质转化, 进一步提高土壤供氮能力, 改善因连作导致的土壤理化性质恶化的现象。这一结果与吴凤芝等[5]和杨凤娟等[19]在黄瓜设施蔬菜生产中轮间作能够提高土壤过氧化氢酶、脲酶及相关酶活性的结果一致。
综上所述, 轮间作处理可能通过提高土壤酶活性、改善辣椒土壤微生物区系进而使得连作辣椒根际土壤得到一定程度的改良, 但本实验未直接测定轮间作处理对土壤理化性质和辣椒生长发育的影响, 因此, 轮间作处理缓解辣椒连作障碍的机制还有待进一步研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|